
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
NH3 +5O2 4NO + 6H2O
2. 3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
3. N2 + O2 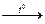 2NO (в природе, во время грозы)
2NO (в природе, во время грозы)
Химические свойства
1. Легко окисляется кислородом и галогенами
2NO + O2 →2NO2 2NO + Cl2 → 2NOCl(хлористый нитрозил)
2. Окислитель 2N+2O + 2S+4O2 → 2S+6O3 + N20
3. Несолеобразующий оксид
Оксид азота (III) N2+3O3
Физические свойства
Темно-синяя жидкость (при низких температурах), t0пл.= -1020C, t0кип.= 3,50С; Выше t0кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение NO2 + NO → N2O3
Химические свойства
Все свойства кислотных оксидов.
N2O3 + 2NaOH →2NaNO2(нитрит натрия) + H2O
Оксид азота (IV) N+4O2 диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t0пл.= -11,20C, t0кип.= 210С.
Получение
1. 2NO + O2 → 2NO2
2. Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства
1. Кислотный оксид, с водой 2NO2 + H2O → HNO3 + HNO2 4NO2 + 2H2O + O2 → 4HNO3
со щелочами 2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
2. Окислитель N+4O2 + S+4O2 → S+6O3 + N+2O
3. Димеризация 2NO2(бурый газ)→N2O4(бесцветная жидкость)
В атмосфере NO2 вещества горят
2NO2+2S→N2+2SO2 10NO2+4P→5N2+4P2O5(>100oC) 2NO2+4Cu→N2+4CuO
Оксид азота (V) N2+5O5
Физические свойства
Кристаллическое вещество, летучее, неустойчивое.
Получение
1. 2NO2 + O3 → N2O5 + O2
2. 2HNO3 +P2O5 → 2HPO3 + N2O5
Химические свойства
1. Кислотный оксид N2O5 + H2O → 2HNO3
2. Сильный окислитель
3. Легко разлагается (при нагревании - со взрывом): 2N2O5 → 4NO2 + O2
|
|
Дата добавления: 2014-01-07; Просмотров: 623; Нарушение авторских прав?; Мы поможем в написании вашей работы!