
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кондуктометрическое титрование
|
|
|
|
Кондуктометрия – это метод установления эквивалентной точки титрования, основанный на измерении электропроводности растворов.
Широко распространенный на практике, этот метод анализа не требует применения индикаторов и особенно удобен в тех случаях, когда необходимо проанализировать мутные, окрашенные или содержащие осадки растворы. Сущность метода состоит в измерении проводимости титруемого раствора как функции объёма прибавляемого реагента. Точку эквивалентности находят по графику “электропроводность – объём титрующего раствора” как точку пересечения двух прямых или точку перегиба. За ходом реакции следят по изменению удельной электропроводности или сопротивления, которое связано с заменой в растворе одних ионов другими (с иной подвижностью).
Рассмотрим титрование сильной кислоты щелочью (рис. 7 а). При титровании раствора кислоты (например, HCl) раствором щелочи (например, NaOH) часть ионов H+ (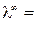 350 (Ом-1 моль-экв-1 см2) заменяется на менее подвижные ионы Na+ (
350 (Ом-1 моль-экв-1 см2) заменяется на менее подвижные ионы Na+ (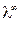 = 50,1 Ом-1 моль-экв-1 см2), поэтому электропроводность раствора падает. Так происходит до точки эквивалентности. При дальнейшем добавлении титранта в растворе, кроме ионов Na+, появляются свободные ионы OH– с очень высокой подвижностью (
= 50,1 Ом-1 моль-экв-1 см2), поэтому электропроводность раствора падает. Так происходит до точки эквивалентности. При дальнейшем добавлении титранта в растворе, кроме ионов Na+, появляются свободные ионы OH– с очень высокой подвижностью (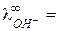 198 Ом-1 моль-экв-1 см2), что приводит к резкому увеличению электропроводности раствора.
198 Ом-1 моль-экв-1 см2), что приводит к резкому увеличению электропроводности раствора.
 |
Рассмотрим титрование слабой кислоты щелочью (рис. 7 б). На “кислотном“ участке титрования электропроводность раствора растёт вследствие замещения слабо диссоциированной кислоты на её сильно диссоциированную соль. После достижения точки эквивалентности наблюдается более сильное увеличение электропроводности, что связано с появлением в растворе высокоподвижных ионов гидроксила. При титровании смеси слабой и сильной кислот щелочью (рис. 7 в) в реакцию нейтрализации в первую очередь будет вступать сильная кислота так как в присутствии сильной кислоты диссоциация слабой будет подавлена. Только после того, как она будет полностью оттитрована, начнет реагировать слабая кислота.
ЛЕКЦИЯ 9
Электродные процессы. Понятие о скачках потенциалов и электродвижущей силе (ЭДС). Электрохимические цепи, гальванические элементы. Стандартный водородный электрод, стандартный электродный потенциал. Классификация электрохимических цепей и электродов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 535; Нарушение авторских прав?; Мы поможем в написании вашей работы!