
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рассмотрим гомогенную реакцию
|
|
|
|
Основные понятия химической кинетики.
Кинетика сложных реакций.
Основные понятия химической кинетики. Кинетика необратимых гомогенных простых реакций. Методы определения порядка реакции. Влияние температуры на скорость реакции.
Для исследования химических процессов обычно применяют два метода: термодинамический и кинетический. Их взаимодополнение иллюстрирует следующий пример. Иногда термодинамически реакция возможна, но вместе с тем эта реакция протекает бесконечно медленно, и тогда с точки зрения практики можно сказать, что она невозможна. Поэтому необходимо изучать кинетику химических реакций.
Пример 1:
Известно, что углерод существует в двух модификациях (графит и алмаз). При стандартных условиях кристаллическая решетка углерода существует в виде графита (гексагональная структура). При высоких давлениях и температурах устойчив алмаз (кубическая кристаллическая структура). Поэтому если при высоких температурах и давлениях графит перевести в алмаз, а затем произвести резкую закалку, то структура алмаза будет сохраняться при нормальных условиях. Он не успеет перейти в графит при быстрой закалке. Таким образом при стандартных условиях алмаз находится в метастабильном (квазиравновесном) состоянии, так как равновесным в этом случае является структура графита. С точки зрения термодинамики при этих условиях алмаз должен превращаться в графит (DGф.п. < 0), но этот процесс протекает бесконечно медленно. (Перестройка алмаза в графит должна протекать с перемещением атомов, а при комнатной температуре такое перемещение атомов почти невозможно). Если же алмаз нагреть до 10000С в вакууме, то процесс сильно ускоряется, и алмаз все же переходит в графит. Особенно быстро этот процесс протекает в присутствии металлического железа, поэтому алмазным инструментом нельзя обрабатывать сплавы на основе железа.
Пример 2:
Для процесса окисления всех органических веществ кислородом воздуха до СО2 и Н2О DG<< 0. Однако в природе, например, залежи нефти остаются неизменными длительное время. Дело в том, что в этом случае процесс окисления протекает просто очень медленно.
Рассмотренная нами ранее химическая термодинамика не изучает скорости реакции, а для химической кинетики именно они являются предметом исследования.
Химической кинетикой называют учение о скоростях и механизмах химических реакций.
 , (1)
, (1)
где А и В - исходные вещества, С и D - продукты реакции; νi - стехиометрические коэффициенты.
Поскольку в реакции участвует несколько веществ, то можно говорить как о скорости реакции в целом, так и о скорости реакции по данному веществу.
Скоростью реакции по данному веществу i называется изменение числа молей i-го вещества в единице объема за единицу времени:
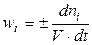 (2)
(2)
Если объем системы не изменяется в ходе реакции (V = const), то
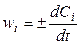 , (3)
, (3)
где Сi = (ni / V) — молярная концентрация i -го вещества.
В процессе реакции концентрация исходных веществ уменьшается (dC i /dt < 0), а концентрация продуктов реакции увеличивается (dCi /dt > 0). Так как скорость реакции всегда величина положительная, то в уравнениях для скорости реакции (2) и (3) знак “+” относится к продуктам реакции, а знак “‑” к исходным веществам.
Скорость реакции в целом равна скорости реакции по данным веществам, деленной на соответствующие стехиометрические коэффициенты.
Для реакции (1) имеем:
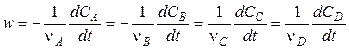 .
.
В химической кинетике также различают
1) истинную (или мгновенную) скорость реакции в момент времени t, равную 
2) среднюю скорость реакции за промежуток времени D t, равную
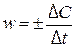 .
.
Выясним, как можно рассчитать Wp в некоторый момент времени t1 графически. Для этого на основании экспериментальных данных строятся кинетические кривые.
Кинетическая кривая - зависимость концентрации участвующих в реакции веществ от времени.
Эти кривые для исходных веществ имеют вид убывающих функций, а для продуктов реакции – вид возрастающих функций.


Рис. 1. Зависимость концентрации (С) исходного вещества (а)
и продукта реакции (б) от времени (t)
Рассмотрим, как определить скорость реакции по данному веществу (wi) в момент времени (t 1), исходя из соответствующих кинетических кривых. Данному времени (t 1) соответствует точка А на кинетических кривых. Если провести касательные к данным кривым в точке А, то, как следует из геометрического смысла производной 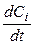 , скорость – это тангенс угла наклона касательных к положительному направлению оси t. Он будет численно равен производной от концентрации по времени в точке t = t 1. Таким образом, истинная скорость реакции
, скорость – это тангенс угла наклона касательных к положительному направлению оси t. Он будет численно равен производной от концентрации по времени в точке t = t 1. Таким образом, истинная скорость реакции
- по кинетической кривой для исходных веществ будет:
wi = –  = – tga = tgb,
= – tga = tgb,
- по кинетической кривой для продуктов реакции:
wi = +  = tga
= tga
Механизмом химической реакции называют совокупность элементарных процессов через которые проходит эта реакция.
Практически все реакции в природе являются сложными, т.е. состоят из совокупности элементарных стадий. Экспериментально установлено, что при Т = const скорость сложных реакций зависит от концентрации исходных, промежуточных веществ, а иногда и от концентрации продуктов реакции и инертных веществ.
Согласно основному постулату химической кинетики скорость реакции в каждый момент времени пропорциональна произведению текущих концентраций реагирующих веществ, возведенных в некоторую степень.
Выражение для скорости сложной реакции всегда находят опытным путем. В общем случае для прямой реакции (1) можно записать
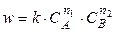 , (4)
, (4)
где n1 - порядок реакции по веществу А,
n2 - порядок реакции по веществу В,
k - константа скорости реакции, не зависящая от концентрации реагирующих веществ.
Физический смысл константы скорости состоит в том, что она численно равна скорости химической реакции при единичных концентрациях всех реагирующих веществ (например, C A = C B = 1 моль/л).
Порядок реакции по веществу определяется как показатель степени n, в которой концентрация этого вещества входит в выражение для скорости реакции, полученное опытным путем.
Общий порядок реакции равен сумме порядков по веществам,
т.е. n = n1 + n 2.
Величины n 1 и n 2 совпадают со стехиометрическими коэффициентами только для простых реакций (одностадийных). Для сложных реакций n 1 ¹ ν А и n 2 ¹ ν B.
Если реакция является простой, то есть протекает в одну стадию (одностадийная реакция), то при T = const ее скорость пропорциональна концентрации реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам в уравнении реакции.
Тогда для скорости прямой реакции (1) можно записать
 , (5)
, (5)
Под молекулярностью реакции понимается число частиц, участвующих в элементарной стадии реакции.
В отличие от порядка реакции, это теоретическое понятие. Молекулярность реакции - всегда целое число (1,2 или 3) (а порядок реакции может быть целым, дробным или даже отрицательным). Молекулярность больше 3 не встречается.
Например, экспериментально показано, что
реакция Cl2 ® Cl + Cl - мономолекулярная,
реакция HI + HI ® H2 + I2 - бимолекулярная,
реакция H + H + M ® H2 + M - тримолекулярная,
где М - третья частица, участвующая в процессе рекомбинации, чтобы отвести избыток энергии и стабилизировать продукт.
Порядок и молекулярность реакции совпадают только для простых реакций или элементарных стадий сложных реакций. Например, реакция взаимодействия оксида азота (II) с хлором является сложной, протекает в две стадии, обе стадии являются бимолекулярными:
2NO + Cl2 ® 2NOCl
1) NO + Cl2 ® NOCl2,
2) NOCl2 + NO ® 2NOCl
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 505; Нарушение авторских прав?; Мы поможем в написании вашей работы!