
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика необратимых гомогенных простых реакций
|
|
|
|
Рассмотрим необратимые гомогенные простые реакции нулевого, первого и второго порядков.
С точки зрения формальной кинетики необратимыми являются такие реакции, для которых через некоторое время с начала их протекания исходные вещества не удается обнаружить аналитическими методами.
Реакции нулевого порядка.
Для реакций нулевого порядка (n = 0) скорость реакции постоянна и не зависит от концентрации исходных веществ. Например, для реакции
А ® B
в соответствии с основным постулатом химической кинетики можно записать
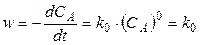 . (6)
. (6)
где СA - текущая концентрация вещества А.
Разделим переменные в уравнении (6)
-dCA = k0 dt,
и проинтегрируем последнее уравнение
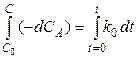 .
.
Здесь С 0 - начальная концентрация вещества А в начальный момент времени t = 0, С - концентрация А в момент времени t (текущая концентрация А).
Результирующее уравнение, описывающее зависимость концентрации вещества А от времени, будет иметь вид:
С = С 0 - k 0 t, (7)
или
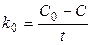 .
.
Единицы измерения k 0 - [концентрация·время‑1].
Если концентрация выражена, например, в моль/л, а время - в сек, то k 0 выражается в моль/(л·сек).
Время, в течение которого концентрация исходного вещества уменьшается в два раза, называется периодом (временем) полупревращения. Оно обозначается t 1/2.
Для реакции нулевого порядка
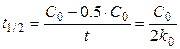 ,
,
т.е. время полупревращения прямо пропорционально начальной концентрации вещества (при увеличении С 0 в 2 раза, t 1/2 увеличивается в 2 раза).
Зависимость текущей концентрации вещества А от времени имеет линейный характер. Она представлена на рис. 2.
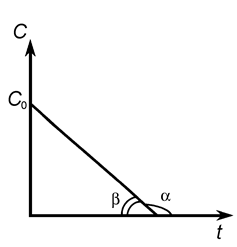
Рис. 2
Реакции нулевого порядка имеют место в тех случаях, когда убыль вещества в результате протекания химической реакции восполняется доставкой его из другой фазы. Например, реакция омыления эфира водой может протекать по нулевому порядку при условии, что взаимная растворимость эфира и воды малы,
СН3СООС2Н5 + Н2О ® СН3СООН + С2Н5ОН
и при уменьшении концентрации эфира в воде из эфирного слоя каждый раз поступает его новая порция.
Нулевой порядок наблюдается также, если скорость процесса лимитируется подачей энергии, необходимой для активации реагирующих молекул (фотосинтез).
Реакции первого порядка.
Рассмотрим реакцию первого порядка
А ® В.
Скорость этой реакции описывается уравнением
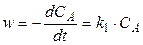 . (8)
. (8)
Разделим переменные в уравнении (8)
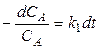 ,
,
проинтегрируем последнее уравнение
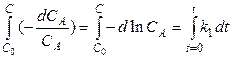 ,
,
где С 0 - начальная концентрация вещества А в начальный момент времени t = 0,
С - текущая концентрация А в момент времени t.
Результирующее уравнение имеет вид:
lnC = lnC0 - k 1 t, (9)
или
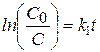
Отсюда 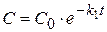 ,
,
т. е. концентрация вещества А в ходе реакции уменьшается экспоненциально (рис. 3).
Очевидно, что концентрация продуктов нарастает тоже по экспоненте.
Единица измерения константы скорости реакции первого порядка - [время-1]:
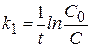 [например, с-1 или мин-1].
[например, с-1 или мин-1].
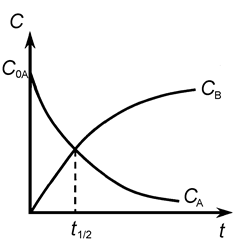
Рис. 3.
Время полупревращения для реакции первого порядка не зависит от начальной концентрации вещества - этот факт характерен только для реакций первого порядка и может служить признаком, определяющим этот тип реакций
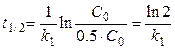 .
.
Зависимость логарифма концентрации вещества А от времени имеет линейный характер, что следует из уравнения (9), и представлена на рис 4.
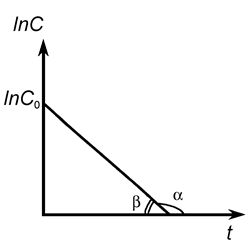
Рис. 4.
(tg a = - k 1 или k 1 = tg b)
По наклону прямой можно определить k 1. К числу односторонних реакций первого порядка относятся реакции радиоактивного распада, некоторые реакции разложения сложных веществ (карбонатов, кристаллогидратов) при их нагревании, реакции изомеризации и др.
Реакции второго порядка.
Рассмотрим реакцию второго порядка
А + В ® D.
Скорость этой реакции, в соответствии с основным постулатом химической кинетики, описывается уравнением
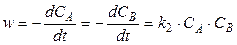 (10)
(10)
Если начальные концентрации веществ А и В равны (С 0А = С 0В = С 0), тогда реакция может быть представлена в виде
2 А ® D.
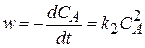
Разделим переменные:
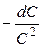 = k2dt
= k2dt
и проинтегрируем
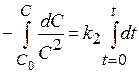
Для нахождения интеграла используем формулы:
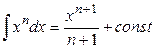

Получим
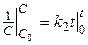
Следовательно
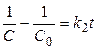 (11)
(11)
Отсюда
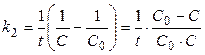 (12)
(12)
Единица измерения константы скорости реакции второго порядка - [концентрация-1·время-1].
Если концентрация выражена в моль/л, а время - в сек, то k 2 выражается в [л/(моль·сек)].
Время полупревращения для реакции второго порядка обратно пропорционально начальной концентрации веществ:
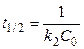 . (13)
. (13)
Зависимость обратной концентрации вещества А от времени имеет линейный характер, что следует из уравнения (11). Она представлена на рис. 5. Эта зависимость дает возможность определить k 2 (k 2 = tga).
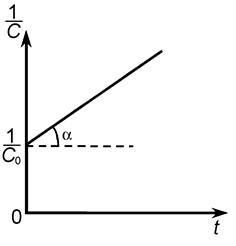
Рис. 5. К расчету константы скорости реакции второго порядка.
В случае, когда для реакции второго порядка А + В ® D начальные концентрации реагирующих веществ не равны (С 0А ¹ С 0В), уравнение для константы скорости принимает следующий вид:
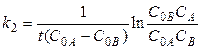 , (14)
, (14)
где СА и СВ - текущие концентрации веществ А и В в момент времени t.
Необратимые реакции n-ого порядка (кроме n = 1).
Аналогичный подход применяется к выводу кинетических уравнений для константы скорости реакций более высоких порядков. Можно показать, что для реакции типа
А + В + С + … ® продукты
при условии С 0А = С 0В = С 0С = … константа скорости определяется уравнением
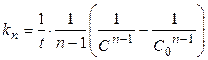 (15)
(15)
Отсюда для времени полупревращения получим
t 1/2 =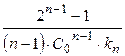 или
или
t 1/2 =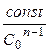
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1715; Нарушение авторских прав?; Мы поможем в написании вашей работы!