
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Формальная кинетика
|
|
|
|
ОСНОВНЫЕ ФОРМУЛЫ И ЗАКОНЫ
Осциллографическая полярография
Импульсная полярография
В импульсной полярографии электрод, находящийся при заданном значении среднего потенциала, поляризуют прямоугольными импульсами, высота которых линейно возрастает во времени. Получаемая при этом полярограмма идентична по форме классической полярограмме, но с сильно увеличенным предельным током, поскольку промежуток времени с момента наложения импульса до момента измерения тока оказывается намного короче периода жизни капли. Чувствительность импульсной и квадратно-волновой полярографии примерно одинакова.
В осциллографической полярографии на ячейку накладывается разность потенциалов, изменяющаяся во времени по определённому закону, и регистрируется зависимость тока от времени. Наибольшее распространение получила осциллографическая полярография в потенциодинамических условиях, иначе называемая линейной вольтамперометрией, когда потенциал электрода линейно изменяется во времени:
Е = Ен – vt,
где Ен – начальный потенциал; v – скорость изменения потенциала. Потенциал Ен выбирают так, чтобы при этом потенциале реагирующее вещество не вступало в электрохимическую реакцию. Затем потенциал быстро смещают в область потенциалов предельного тока диффузии. Чувствительность осциллографической полярографии близка к чувствительности классической и переменноточной полярографии в аналогичных условиях.
Для определения ультрамалых количеств катионов металлов в растворах применяют осциллографическую полярографию с накоплением, или инверсионную полярографию. Для этого Ен висячей капли (или какого-нибудь индифферентного электрода) выбирают таким образом, чтобы определяемые катионы могли разрядиться с образованием амальгамы или металлического осадка на поверхности твёрдого электрода, а затем линейно смещают потенциал электрода в анодную сторону и измеряют ток анодного растворения определяемого металла. При достаточно большом времени предварительной выдержки можно накопить на электроде определяемое вещество, концентрация которого в растворе лежит за пределами чувствительности обычного полярографического метода.
ПРИЛОЖЕНИЕ 1
Скоростью химической реакции v называется количество молекул данного сорта, реагирующих в единицу времени в единице объёма; [ v ] = моль/(м3×с). Основной постулат химической кинетики: скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в некоторых степенях:
v = k  ,
,
ni - порядок реакции по данному веществу;
k - константа скорости химической реакции, k зависит от природы реакции и является функцией температуры; v = k, если  , то есть константа скорости химической реакции есть скорость реакции при условии, что концентрации реагирующих веществ равны 1; k иногда называют удельной скоростью химической реакции. Размерность константы скорости зависит от порядка реакции.
, то есть константа скорости химической реакции есть скорость реакции при условии, что концентрации реагирующих веществ равны 1; k иногда называют удельной скоростью химической реакции. Размерность константы скорости зависит от порядка реакции.
Средняя скорость реакции:
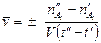 ,
,
 и
и  - число молей одного из веществ в начальный t¢ и конечный t¢¢ моменты времени; V - объем системы. Знак «-» в выражении стоит тогда, когда мы следим за ходом реакции по изменению количества одного из исходных веществ, знак «+» используют, если скорость реакции определяют по ее продукту.
- число молей одного из веществ в начальный t¢ и конечный t¢¢ моменты времени; V - объем системы. Знак «-» в выражении стоит тогда, когда мы следим за ходом реакции по изменению количества одного из исходных веществ, знак «+» используют, если скорость реакции определяют по ее продукту.
Если t¢¢ - t¢ ® 0, то получим истинную скорость реакции (скорость реакции в данный момент времени), рассчитанную на единицу стехиометрического коэффициента
v = ± 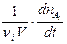 .
.
Если V = const, то v = ± 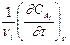 .
.
Таблица 5
Характеристики необратимых реакций различного порядка
| Порядок реакции | Дифференциальное уравнение скорости реакции | Выражение для константы скорости реакции k и количества вещества | Размерность константы скорости реакции | Выражение для времени полураспада |
| 1-й |
 = k (a - x) = k (a - x)
| k =  ln ln  k = k =  ln ln  a - x = ae-kt
x = a (1 - e-kt )
a - x = ae-kt
x = a (1 - e-kt )
| t –1: с–1, мин –1, час–1 | t = ln 2 / k |
| 2-й а = b |  = k (a - x)2 = k (a - x)2
| k = 
| 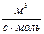
| t = 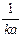
|
| 2-й а ¹ b |  =
k (a - x)(b – x) =
k (a - x)(b – x)
| k =
 ln ln 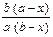
| 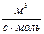
| |
| n -й |
 = k (a - x) n = k (a - x) n
| k = 
| t =

| |
| Нулевой |  = k = k
| x = kt | 
| t = a /2k |
| Обозначения: а и b – исходные количества реагирующих веществ А и В, моль; х – количество вещества А, прореагировавшее к моменту времени t, моль; t – период полупревращения (время полураспада) вещества А; С о – исходная концентрация вещества А, С – концентрация вещества А в момент времени |
Таблица 6
Сложные реакции: обратимые, параллельные, последовательные
| Реакция | Дифференциальное уравнение скорости реакции | Выражение для константы скорости реакции и количества вещества |
| Обратимые реакции 1-го порядка |  = k 1 (a – x) – k 2 (b + x); = k 1 (a – x) – k 2 (b + x);
 = (k 1 + k 2) (L – x),
где L = = (k 1 + k 2) (L – x),
где L = 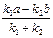 =
= =
= 
| k 1 + k 2 =  ln ln  k =
k =  ln ln 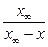
|
| Обратимые реакции 2-го порядка |  = k 1 (a – x)2 – k 2 x 2; = k 1 (a – x)2 – k 2 x 2;
 = (k 1 – k 2)×
× (x 2 – 2 = (k 1 – k 2)×
× (x 2 – 2  x + x +  ); );
 =
= (k 1 – k 2) × (m 1 – x) (m 2 – x) =
= (k 1 – k 2) × (m 1 – x) (m 2 – x)
| k 1 – k 2 =  × ×  ×
× ln ×
× ln  ,
где m 1, 2 = ,
где m 1, 2 = 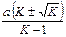 –
корни квадратного уравнения
x 2 – 2 –
корни квадратного уравнения
x 2 – 2  x + x +  = 0 = 0
|
| Параллельные реакции 1-го порядка |  = =  + +  =
(k 1 + k 2) (a – x) =
(k 1 + k 2) (a – x)
| k 1 + k 2 =  ln ln 
|
| Параллельные реакции 2-го порядка |
 = (k 1 + k 2)(a – x)(b – x) = (k 1 + k 2)(a – x)(b – x)
| k 1 + k 2 =
 ln ln 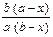
|
Окончание Табл. 6
Сложные реакции: обратимые, параллельные, последовательные
| Реакция | Дифференциальное уравнение скорости реакции | Выражение для константы скорости реакции и количества вещества |
| Последовательные реакции 1-го порядка | Скорость превращения А:
 = k 1 (a – x);
скорость превращения В: = k 1 (a – x);
скорость превращения В:
 =
k 1 (a – x) – k 2 (x – y) =
k 1 а =
k 1 (a – x) – k 2 (x – y) =
k 1 а  – k 2 (x – y) – k 2 (x – y)
| a – x = а  ;
x – y =
а ;
x – y =
а  ( ( – –  );
y = a (1 – );
y = a (1 –   +
+ +
+   ) )
|
| Обозначения: а и b – исходные количества веществ А и В, моль; х – количество вещества А, прореагировавшее к моменту времени t, моль; y – количество вещества В, прореагировавшее к моменту времени t, моль; К = k 1 / k 2 – константа равновесия обратимой реакции; х ¥ – количество вещества А, прореагировавшее к моменту наступления равновесия (к концу реакции), моль. |
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 503; Нарушение авторских прав?; Мы поможем в написании вашей работы!