
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости реакции от температуры. Правило Вант-Гоффа: при повышении температуры на 10оС скорость реакции возрастает в 2–4 раза
|
|
|
|
Правило Вант-Гоффа: при повышении температуры на 10оС скорость реакции возрастает в 2–4 раза. Для характеристики зависимости скорости химической реакции от Т введен температурный коэффициент скорости реакции g:
g =  ,
,
где k T+10 и k T – константы скорости химической реакции при температуре Т+10 и Т. В среднем этот коэффициент равен 3. Пользуясь температурным коэффициентом скорости реакции, можно рассчитывать константы скоростей при различных Т:
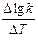 =
=  .
.
Если считать, что в пределах 10о температурный коэффициент остается постоянным, можно записать
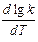 =
=  ,
, 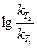 =
=  (T2 – T1),
(T2 – T1),
где 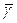 – средний температурный коэффициент в интервале температур Т2 – Т1.
– средний температурный коэффициент в интервале температур Т2 – Т1.
Такая оценка зависимости скорости реакции от температуры носит весьма приближенный характер, применима только в очень ограниченном интервале температур и потому имеет малую практическую ценность. Более обоснованную зависимость константы скорости реакции от Т можно получить с помощью уравнения изохоры или изобары химической реакции. Таким путем выведено уравнение Аррениуса, характеризующее зависимость константы скорости химической реакции от температуры
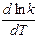 =
= 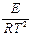 .
.
Величина Е имеет размерность энергии и носит название энергии активации. Энергию активации можно определить как тот избыток энергии по сравнению со средней энергией молекул при данной температуре, которой должны обладать молекулы, чтобы они могли вступить в химическую реакцию.
Уравнение Аррениуса в интегральной форме имеет вид (считаем, что Е – величина постоянная):
ln k = –  + ln C или k = C e – E /RT.
+ ln C или k = C e – E /RT.
(ln C – константа интегрирования). Константами, характеризующими реакцию, являются предэкспоненциальный множитель С и энергия активации Е.
Если уравнение Аррениуса проинтегрировать в пределах от Т1 до Т2, то получим
 =
=  =
=  ,
,
k 2 – константа скорости химической реакции при Т2 , k 1 – то же при Т1 . Таким образом, зная величину константы скорости реакции при одной Т, можно вычислить ее величину при другой Т.
Энергию активации можно определить и не зная констант скоростей. Отношение скоростей реакции при двух температурах можно в общем виде записать следующим образом:
 .
.
Если реакцию проводят так, что концентрации участников при двух температурах одинаковы, то
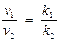 .
.
Тогда 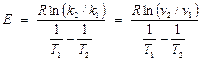 .
.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 393; Нарушение авторских прав?; Мы поможем в написании вашей работы!