
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионное равновесие в растворах электролитов
|
|
|
|
1. Диссоциация воды. рН растворов
Диссоциация воды протекает по схеме
Н2О Û Н+ + ОН–.
Константу равновесия можно выразить как
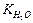 =
= 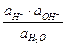 .
.
Так как степень диссоциации воды очень мала, то  можно считать постоянной и ввести ее в значение константы диссоциации
можно считать постоянной и ввести ее в значение константы диссоциации
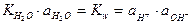 .
.
При Т = const Kw = const и не зависит от концентрации ионов Н+ и ОН–; Kw называется ионным произведением воды. При 25оС Kw = 1,008 × 10–14. В нейтральном растворе  = 10–7 моль/л.
= 10–7 моль/л.
рН = - lg  - водородный показатель, введенный Зеренсеном (1909). рН = 7 отвечает нейтральному раствору только при 25оС. Kw очень сильно зависит от Т (увеличивается в 100 раз в интервале 20 – 100оС), то есть с ростом Т концентрация образующихся ионов Н+ и ОН– будет увеличиваться, и при t < 25оС рН = 7 будет соответствовать кислому раствору, а при t > 25оС - щелочному.
- водородный показатель, введенный Зеренсеном (1909). рН = 7 отвечает нейтральному раствору только при 25оС. Kw очень сильно зависит от Т (увеличивается в 100 раз в интервале 20 – 100оС), то есть с ростом Т концентрация образующихся ионов Н+ и ОН– будет увеличиваться, и при t < 25оС рН = 7 будет соответствовать кислому раствору, а при t > 25оС - щелочному.
Кислые растворы – такие, в которых [Н+] > [ОН–]; щелочные - такие, где [ОН–] > [Н+]. Так как мерой кислотности служит [Н+], то в ряду кислот более сильной будет та, у которой при одинаковой аналитической концентрации [Н+] выше (то есть больше степень диссоциации).
Величины концентраций ионов Н+ в выражении для рН можно использовать взамен активностей только в случае достаточно разбавленных растворов.
2. Диссоциация слабых электролитов
При диссоциации слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами. Рассмотрим простейший пример, когда молекула распадается только на два иона:
СН3СООН + Н2О Û СН3СОО– + Н3О+.
На основании закона действующих масс напишем выражение для константы равновесия Ка:
Ка =  .
.
Ка зависит от Т, но не зависит от концентрации растворенного вещества.
Активность растворителя (воды) в разбавленных растворах можно считать постоянной:
Ка ×  = Кд =
= Кд = 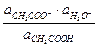 .
.
Величина Кд называется термодинамической константой диссоциации (или просто константой диссоциации).
Заменив активности произведениями аналитических концентраций на соответствующие коэффициенты активности, получим
Кд =  ×
× 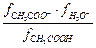 = Кс ×
= Кс × 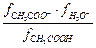 ,
,
где Кс - классическая константа диссоциации.
Для точных расчетов ионных равновесий необходимо пользоваться термодинамической константой диссоциации Кд . Коэффициенты активности можно рассчитать по уравнениям Дебая – Гюккеля. Согласно теории Дебая – Гюккеля, отличие активности от концентрации обусловлено только кулоновским взаимодействием, поэтому для незаряженных частиц СН3СООН  = 1 и, следовательно,
= 1 и, следовательно,
Кд = Кс × 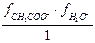 = Кс ×
= Кс × 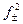 .
.
3. Гидролиз солей
Гидролиз соли слабой кислоты и сильного основания (CH3COONa):
СН3СОО– + Н2О Û СН3СООН + ОН–,
Ка =  .
.
В разбавленных растворах  можно считать постоянной:
можно считать постоянной:
Ка ×  = Кг =
= Кг =  = Кw / Кд,к,
= Кw / Кд,к,
где Кг - константа гидролиза, Кд,к – константа диссоциации слабой кислоты. Аналогично для соли сильной кислоты и слабого основания (NH4Cl) можно получить
Кг = Кw / Кд,о.
Для соли слабой кислоты и слабого основания
CH3COO– + NH4+ + H2O Û CH3COOH + NH4OH,
Кг = Кw / Кд,к × Кд,о.
Таким образом, константы гидролиза солей можно рассчитать, зная константы диссоциации соответствующих слабых кислот и оснований.
Водородный показатель раствора гидролизованной соли определяется выражением
рН = 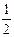 р K w ±
р K w ± 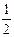 р Кд,к (Кд,о ) ±
р Кд,к (Кд,о ) ± 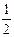 lg c,
lg c,
в котором знак (+) относится к соли слабой кислоты, а знак (–) – к соли слабого основания.
Наряду с константой гидролиза реакции гидролиза характеризуются также степенью гидролиза. Степень гидролиза b - доля молекул соли, подвергшихся гидролизу, от общего числа молекул соли.
Для гидролиза CH3COONa
b =  , Кг =
, Кг = 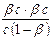 =
=  ,
,
где с - исходная концентрация CH3COONa.
В случае гидролиза соли слабого основания и сильной кислоты связь между Кг и b точно такая же. Зная Кг,можно рассчитать b, решая уравнение
с b2 + Кг b - Кг = 0.
При малых значениях b (b << 1 и 1-b» 1) Кг = с b2 и b = 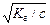 .
.
Если соль образована слабой кислотой и слабым основанием,
Кг =  =
=  .
.
При b<< 1 Кг = b2 и b = 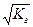 .
.
Как видно, степень гидролиза солей слабых кислот и сильных оснований и солей сильных кислот и слабых оснований уменьшается с ростом концентрации соли и увеличивается при разбавлении растворов; степень гидролиза солей слабого основания и слабой кислоты от концентрации раствора практически не зависит.
4. Буферные растворы
Буферными растворами называются растворы с устойчивой активностью водородных ионов, то есть с определенным значением рН, которое практически не зависит от разбавления раствора и слабо меняется при прибавлении к раствору сильной кислоты или сильного основания - эта способность и называется буферностью. Буферные растворы могут образовывать следующие пары:
а) слабая кислота и ее соль с сильным основанием. Пример - смесь уксусной кислоты и ацетата Na.
Кд,к = 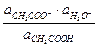 ;
; 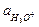 = Кд,к
= Кд,к  .
.
Если к раствору слабой кислоты добавлена соль этой кислоты и сильного основания, то диссоциация кислоты подавляется, и  равна общей активности кислоты ак (в растворе смеси уксусной кислоты и ацетата натрия), а
равна общей активности кислоты ак (в растворе смеси уксусной кислоты и ацетата натрия), а 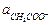 можно считать равной активности ацетата натрия ас:
можно считать равной активности ацетата натрия ас:
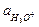 = Кд,к
= Кд,к  .
.
Подбирая различные отношения концентраций кислоты и соли, можно получить растворы с различными значениями рН. При данном составе раствора значение рН мало зависит от Т.
б) слабое основание и его соль с сильной кислотой. Пример - NH4OH и NH4Cl. Для этой сопряженной пары получим
Кд,о =  =
= 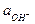
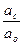 ;
;
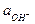 = Кд,о
= Кд,о  ;
; 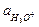 =
= 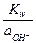 =
= 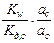 .
.
в) две соли на разных ступенях диссоциации: Na2HPO4 и NaH2PO4 .
Анализ уравнений показывает, почему разбавление буферных растворов практически не меняет рН растворов: рН зависит не от абсолютных значений концентраций кислоты и ее соли, а от их соотношения.
Количественной характеристикой буферности является буферная емкость - число эквивалентов щелочи или кислоты, необходимое для изменения рН на единицу:
b¢ = 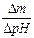 .
.
Величина b¢ зависит от Кд,к (Кд,о) и максимальна в области рН, близкой к р К. Буферные емкости одного и того же раствора относительно кислоты и щелочи различны.
5. Произведение растворимости
При растворении твердых веществ в воде может быть достигнуто состояние насыщения раствора, при котором для данной Т растворение вещества прекратится, при этом твердая фаза будет находиться в равновесии с растворенным веществом. Если вещество (соль MnAm) является электролитом, то в растворе установится равновесие
Mn Am (тв.) Û n Mz+ + m Az–.
Константа диссоциации соли
Кд = 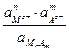 ;
;
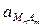 при данной Т является величиной постоянной.
при данной Т является величиной постоянной.
Кд × 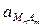 = ПР =
= ПР = 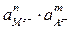 .
.
Таким образом, в насыщенном растворе соли произведение активностей ее ионов есть величина постоянная, она называется произведением растворимости.
Если соль малорастворима и ее раствор разбавлен, то в выражении для ПР активности можно заменить концентрациями.
Из уравнения для ПР следует, что при добавлении к раствору малорастворимой соли хорошо растворимого соединения, имеющего общий ион с малорастворимой солью, растворимость соли будет уменьшаться. Кроме того, добавление посторонней соли к раствору увеличивает ионную силу этого раствора и уменьшает коэффициент активности той соли, которая находилась в растворе до введения посторонней добавки.
Неравновесные явления в растворах электролитов:
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2345; Нарушение авторских прав?; Мы поможем в написании вашей работы!