
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Неравновесные электродные процессы
|
|
|
|
Перенапряжение реакции выделения водорода в широкой области плотностей тока подчиняется эмпирической формуле Тафеля, которая связывает перенапряжение с плотностью тока, проходящего через раствор, то есть со скоростью электрохимического процесса:
h = а + b lg i,
где h – перенапряжение, В; a и b – константы; i – плотность тока, А/см2.
Смысл величины а: а дает значение перенапряжения при i = 1 А/см2. Величина а существенно зависит от материала электрода.
Величина b мало зависит от материала электрода и является характеристикой самого электрохимического процесса. Для реакции катодного выделения водорода в большинстве случаев она приблизительно равна 2×2,303RT/zF, то есть 0,116 В при z = 1 и комнатной температуре. Это значит, что при увеличении плотности тока в 10 раз h увеличивается на 0,116 В; таким образом, b является мерой изменения перенапряжения с изменением плотности тока. Однако величина b в ряде случаев может составлять и 0,030 В.
Формула Тафеля соответствует опыту в очень широком интервале величин i; при очень малых плотностях тока она, естественно, неприменима. В области малых отклонений от равновесного потенциала наблюдается линейная связь между h и i:
h = R i.
Электродная поляризация DЕ, обусловленная замедленной диффузией разряжающихся частиц к катоду (концентрационная поляризация), определяется выражением
DЕ =  ln
ln 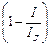 ,
,
где Iд – предельный диффузионный ток:
Iд = zF DS 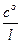 .
.
Здесь z – заряд разряжающихся частиц, D – их коэффициент диффузии, S – площадь электрода, l – толщина диффузионного слоя (слоя, в котором происходит изменение концентрации разряжающихся частиц от с о в глубине раствора до с S на поверхности электрода),
с S = с о 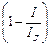 .
.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
| Антропов Л.И. Теоретическая электрохимия / Л.И.Антропов. М.: Высшая школа, 1984. 520 с. |
| Багоцкий В.С. Основы электрохимии / В.С.Багоцкий. М.: Химия, 1988. 400 с. |
| Герасимов Я.И. Курс физической химии / Я.И.Герасимов. М.: Химия, 1969. Т.1. 592 с. |
| Герасимов Я.И. Курс физической химии / Я.И.Герастмов. М.: Химия, 1973. Т.2. 624 с. |
| Голиков Г.А. Руководство по физической химии / Г.А.Голиков. М.: Высшая школа, 1988. 384 с. |
| Дамаскин Б.Б. Введение в электрохимическую кинетику / Б.Б.Дамаскин, О.А.Петрий. М.: Высшая школа, 1983. 400 с. |
| Дамаскин Б.Б. Электрохимия / Б.Б.Дамаскин, О.А.Петрий. М.: Высшая школа, 1987. 296 с. |
| Дамаскин Б.Б. Электрохимия / Б.Б.Дамаскин, О.А.Петрий, Г.А.Цирлина. М.: Химия, 2001. 624 с. |
| Еремин В.В. Задачи по физической химии / В.В.Еремин, С.И.Каргов, И.А.Успенская и др. М.: Экзамен, 2003. 320 с. |
| Кудряшов И.В. Сборник примеров и задач по физической химии /И.В.Кудряшов, Г.С.Каретников. М.: Высшая школа, 1991. 528 с. |
| Панченков Г.М. Химическая кинетика и катализ / Г.М.Панченков, В.П.Лебедев. М.: Химия, 1985. 592 с. |
| Полторак О.М. Термодинамика в физической химии / О.М.Полторак. М.: Высшая школа, 1991. 320 с. |
| Полторак О.М. Физико-химические основы неорганической химии / О.М.Полторак, Л.М.Ковба. М.: Изд-во МГУ, 1984. 288 с. |
| Стромберг А.Г. Физическая химия / А.Г.Стромберг, П.Д.Семченко. М.: Высшая школа, 1988. 496 с. |
| Шаталов А.Я. Введение в электрохимическую термодинамику / А.Я.Шаталов. М.: Высшая школа, 1984. 216 с. |
| Эмануэль Н.М. Курс химической кинетики / Н.М.Эмануэль, Д.Г.Кнорре. М.: Высшая школа, 1984. 464 с. |
ОГЛАВЛЕНИЕ
| Раздел IV. Химическая кинетика и катализ | ||
| Лекция 30. Скорость химической реакции. Двусторонние и односторонние (обратимые и необратимые) реакции. Молекулярность и порядок реакции. Кинетическая классификация реакций | ||
| Лекция 31. Необратимые реакции первого, второго, n-го и нулевого порядка | ||
| Лекция 32. Сложные реакции: обратимые, параллельные, последовательные | ||
| Лекция 33. Методы определения порядка реакций. Влияние температуры на скорость реакций: правило Вант-Гоффа, уравнение Аррениуса, энергия активации и ее экспериментальное определение | ||
| Лекция 34. Теория активных столкновений. Применение теории столкновений к бимолекулярным реакциям | ||
| Лекция 35. Теория активного комплекса (переходного состояния) | ||
| Лекция 36. Цепные реакции. Теория простых и разветвленных цепей. Теория взрывов и воспламенений. Тепловой взрыв | ||
| Лекция 37. Сопряженные реакции | ||
| Лекция 38. Фотохимические реакции. Основные законы фотохимии. Квантовый выход. Типы фотохимических процессов | ||
| Лекция 39. Мономолекулярные и тримолекулярные реакции. Реакции в растворах | ||
| Лекция 40. Методы изучения кинетики сложных реакций | ||
| Лекция 41. Общие сведения о катализе. Гомогенный катализ. Катализ кислотами и основаниями | ||
| Лекция 42. Гетерогенный катализ. Теория промежуточных соединений | ||
| Лекция 43. Теория активных центров в гетерогенном катализе | ||
| Лекция 44. Мультиплетная теория катализа. Теория активных ансамблей. Электронные представления в гетерогенном катализе | ||
| Раздел V. Электрохимия | ||
| Лекция 45. Предмет электрохимии. Особенности электрохимической реакции. Электрохимическая система. Законы Фарадея | ||
| Лекция 46. Теория электролитической диссоциации Аррениуса. Закон разбавления Оствальда. Недостатки терии Аррениуса и их причины | ||
| Лекция 47. Причины диссоциации. Сольватация и гидратация | ||
| Лекция 48. Активность и коэффициент активности электролитов. Ионная сила раствора. Распределение ионов в растворе | ||
| Лекция 49. Теория электролитов Дебая и Гюккеля | ||
| Лекция 50. Электропроводность (удельная и эквивалентная), ее зависимость от концентрации и температуры. Подвижность ионов, закон Кольрауша, аномальная подвижность ионов водорода и гидроксила | ||
| Лекция 51. Зависимость подвижности ионов от концентрации и температуры, электрофоретический и релаксационный эффекты, эффекты Вина и Дебая – Фалькенгагена, уравнение Онзагера. Числа переноса ионов, методы их определения | ||
| Лекция 52. Ионное равновесие в растворах электролитов: диссоциация воды, рН растворов, диссоциация слабых электролитов, гидролиз, буферные растворы, произведение растворимости | ||
| Лекция 53. Электрохимические элементы. Электродвижущая сила. Термодинамика гальванического элемента. | ||
| Лекция 54. Двойной электрический слой, механизм возникновения и строение | ||
| Лекция 55. Электродный потенциал. Водородная шкала потенциалов. Формула Нернста. Стандартный электродный потенциал | ||
| Лекция 56. Классификация электродов. Электроды первого и второго рода. Электроды сравнения. Газовые электроды. Амальгамные электроды. Окислительно-восстановительные электроды, правило Лютера. Хингидронный электрод, измерение рН | ||
| Лекция 57. Классификация электрохимических цепей. Физические цепи. Концентрационные цепи. Химические цепи. Аккумуляторы. | ||
| Лекция 58. Измерение ЭДС как метод физико-химического исследования: определение коэффициентов активности, рН, произведения растворимости. Потенциометрия. Ион-селективные электроды | ||
| Лекция 59. Электролиз. Токи обмена. Поляризация электрода, перенапряжение. Концентрационная и электрохимическая поляризация. Напряжение разложения | ||
| Лекция 60. Перенапряжение выделения водорода. Уравнение Тафеля. Теории водородного перенапряжения | ||
| Лекция 61. Электроосаждение металлов. Анодное растворение и пассивность металлов. Коррозия металлов и борьба с ней | ||
| Лекция 62. Электрохимические методы анализа. Кондуктометрия. Электроанализ и кулонометрия. Стационарная вольтамперометрия | ||
| Лекция 63. Полярография. Нестационарная вольтамперометрия | ||
| Приложение 1. Основные формулы и законы | ||
| Библиографический список |
Учебное издание
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1033; Нарушение авторских прав?; Мы поможем в написании вашей работы!