
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аккумуляторы. Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы)
|
|
|
|
Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы). В аккумуляторах при пропускании через них тока от внешней цепи (заряжение) происходят химические изменения в электродах и растворах, близких к обратимым, и работа электрического тока аккумулируется (запасается) в форме свободной энергии продуктов реакции. Заряженный аккумулятор дает ток при разряжении, после чего вновь может быть заряжен.
Наиболее широко используют кислотный свинцовый, щелочной кадмиево-никелевый и щелочной серебряно-цинковый аккумуляторы.
СВИНЦОВЫЙ АККУМУЛЯТОР в заряженном состоянии представляет собой элемент
(-) Pb êPbSO4 êH2SO4 (32-34 %) êPbO2 êPb (+).
Здесь имеется два электрода второго рода: свинцово-сульфатный, обратимый по отношению к сульфат-ионам, и свинцово-диоксидный, обратимый по отношению к гидроксильным ионам, а следовательно, и к ионам водорода (как всякий металлоксидный электрод).
При работе аккумулятора протекают следующие электродные реакции:
на левом электроде (свинцово-сульфатном)
Pb + SO42– 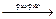 PbSO4 (т) + 2 е;
PbSO4 (т) + 2 е;
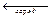
на правом электроде (свинцово-диоксидном)
PbO2 (т) + 4H+ + SO42– + 2 e 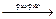 PbSO4 (т) + 2H2O.
PbSO4 (т) + 2H2O.
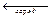
Суммарная реакция в цепи
Pb + PbO2 (т) + 4H+ + 2SO42– 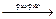 2 PbSO4 (т) + 2H2O,
2 PbSO4 (т) + 2H2O,
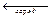
откуда ЭДС цепи равна
Е = Ео + 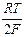 ln
ln 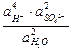 = Ео +
= Ео +  ln
ln 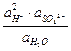 =
=
= Ео +  ln
ln 
При 25оС Е = 2,04 + 0,059 lg  .
.
В свинцовых аккумуляторах применяются концентрированные растворы серной кислоты, поэтому активность воды здесь не будет постоянной и ее нельзя включать в величину Ео.
КАДМИЕВО-НИКЕЛЕВЫЙ АККУМУЛЯТОР в заряженном состоянии представляет собой электрохимический элемент
(-) Cd êCd(OH)2ï KOH (20%) êêKOH (20%) ï Ni(OH)2, Ni(OH)3 êNi (+)
Суммарная реакция в этом элементе
Cd + 2Ni(OH)3  Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
Значение DG для этой реакции не должно зависеть от концентрации щелочи, так как в суммарной реакции участвуют только твердые вещества. Однако реакции на электродах сопровождаются изменением концентрации щелочи и образованием разности концентраций у двух электродов:
Cd + 2OH–  Cd(OH)2 + 2 e
Cd(OH)2 + 2 e
2Ni(OH)3 + 2 e 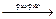 2Ni(OH)2 + 2OH–
2Ni(OH)2 + 2OH–
Тем не менее, в результате естественного перемешивания в условиях близости электродов эта разность концентраций практически не возникает. ЭДС кадмиево-никелевого аккумулятора равна приблизительно 1,36 В.
ЖЕЛЕЗО-НИКЕЛЕВЫЙ АККУМУЛЯТОР. В этом щелочном аккумуляторе кадмий и окись кадмия заменены железом и закисью железа.
СЕРЕБРЯНО-ЦИНКОВЫЙ АККУМУЛЯТОР. Анодом является пористая цинковая пластинка, катодом - окислы серебра Ag2O и AgO. Электролит - концентрированный раствор КОН, насыщенный цинкатом калия Zn(OK)2. Заряженный аккумулятор может быть представлен в виде
(-) Zn êZn(OK)2, KOH (40%) êAgO или Ag2O êAg (+)
Суммарная реакция в этом элементе
AgO + Zn 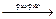 ZnO + Ag
ZnO + Ag
Процесс идет в две стадии: AgO восстанавливается сначала до Ag2O, затем - до металлического серебра. ЭДС элементов с катодом AgO равна 1,86 В, с катодом Ag2O - 1,58 – 1,60 В (при 25оС). После разряда аккумулятора имеем
(-) Zn êZnO êZn(OK)2, KOH (40%) êAg (+)
В этих аккумуляторах, в отличие от свинцовых и щелочных, электролит в реакциях заряда и разряда не участвует, поэтому его количество можно быть очень мало. Это позволило создать аккумуляторы, имеющие очень эффективную конструкцию: электроды помещены вплотную друг к другу и разделены только тонким слоем целлофана. Весь электролит находится в порах электродов. Серебряно-цинковые аккумуляторы имеют большую емкость, высокую энергию и высокую мощность на единицу массы и объема. Они широко применяются там, где необходимы аккумуляторы небольшого размера.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 728; Нарушение авторских прав?; Мы поможем в написании вашей работы!