
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Рауля. В разбавленных растворах неэлектролитов при постоянной температуре величина относительного понижения давления пара растворителя равна мольной доле
|
|
|
|
В разбавленных растворах неэлектролитов при постоянной температуре величина относительного понижения давления пара растворителя равна мольной доле растворённого нелетучего вещества.
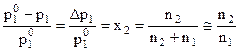 при
при  n2 <<n1
n2 <<n1
где р0 – давление пара над чистым растворителем, р – давление пара над раствором, х2 – мольная доля растворённого вещества, n1 и n2 – числа молей растворителя и растворённого вещества, Δр = р0 – р - понижение упругости пара над раствором,
 - относительное понижение упругости пара раствора (депрессия)
- относительное понижение упругости пара раствора (депрессия)
Изменением понижения давления пара над раствором можно пользоваться для определения молярной массы растворённого вещества. Пусть nA – число молей растворителя, nВ – число молей растворённого вещества,
nВ = mB/MB, где mB - масса растворённого вещества, MB - его молярная масса, nА = mА/MА, где mА - масса растворителя, MА - его молярная масса.
подставляя nА и nВ в уравнение закона Рауля, получаем:
Последнее приближённое равенство записано с учётом того, что раствор разбавленный и nB<<nA. Итак,
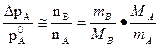
или
ΔрМВmA = р0 МAmB,
отсюда

|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 360; Нарушение авторских прав?; Мы поможем в написании вашей работы!