
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вывод основного уравнения ЭДС гальванического элемента
|
|
|
|
Лекция 12. Уравнение Нернста для ЭДС и электродных потенциалов
12.1 Вывод основного уравнения ЭДС гальванического элемента
12.2 Уравнение Нернста, применение
12.3 Классификация электродов в электрохимии: электроды первого рода, второго рода, газовые электроды, редокси-электроды
Химическая энергия реакции, протекающей в гальваническом элементе, является источником электрической энергии. Например, если в элементе Якоби-Даниэля электрохимическую реакцию Zn + Cu2+=Zn2+ + Сu провести в обратимых условиях, то работа, совершаемая ею, максимально равна работе электрических сил
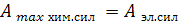 (12.1)
(12.1)
Если все процессы протекают обратимо, при постоянстве температуре и давлении, то электрическая работа, совершаемая элементом, равна произведению ЭДС на количество переносимого электричества
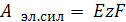 (12.2)
(12.2)
где z – число электронов, переносимых во время протекания окислительно-восстановительной реакции;
F – число Фарадея;
E – ЭДС элемента, В.
Максимальная работа реакции определяется уменьшением изобарно-изотермического потенциала по уравнению изотермы
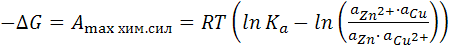 (12.3)
(12.3)
где 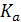 – константа равновесия реакции, выраженная через активность;
– константа равновесия реакции, выраженная через активность;
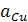 и
и 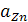 – активности кристаллических меди и цинка, равные единице;
– активности кристаллических меди и цинка, равные единице;
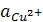 и
и 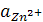 – активности потенциалопределяющих ионов в растворе;
– активности потенциалопределяющих ионов в растворе;
R – универсальная газовая составляющая, равная 8,314 Дж/моль·град;
T – абсолютная температура.
В растворах сильных электролитов активность ионов определяется уравнением
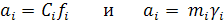
где f – молярность раствора;
γ – моляльность раствора.
Вывод уравнения изотермы химической реакции приводится в учебной литературе в разделе термодинамики. При самопроизвольном протекании процесса Amax хим. сил > 0, подставляя значение максимальной работы электрических и химических сил в уравнение (12.3), получим
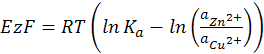 (12.4)
(12.4)
откуда ЭДС элемента равна
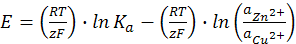 (12.5)
(12.5)
Переходя от натуральных к десятичным логарифмам и обозначая множитель 2,303 (RT/z F) через b, получим
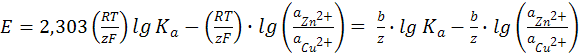 (12.6)
(12.6)
Если активности ионов, определяющих электродные потенциалы, равны единице 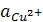 =
= 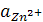 = 1, имеем стандартную ЭДС, равную
= 1, имеем стандартную ЭДС, равную
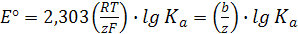
Подставляя Е° в уравнение (12.6) и изменяя знак, получаем для ЭДС элемента Якоби-Даниэля выражение
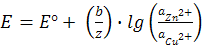 (12.7)
(12.7)
Здесь заряды ионов Сu2+ и Zn2+ равны и количество переносимых электронов равно 2 (z = 2). В общем случае для цепи
(–) Ме 1 | 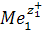 (a1) ||
(a1) ||  (а2) | Ме2 (+),
(а2) | Ме2 (+),
если число электронов, участвующих в окислительно-восстановительных процессах, протекающих на электродах, различно (z1≠ z2) имеем
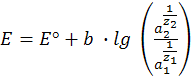 (12.8)
(12.8)
где а1 и а2 — активности потенциалопределяющих ионов в растворе левого и правого электродов. Это и есть основное уравнение ЭДС гальванического элемента, его часто называют уравнением Нернста для определения ЭДС гальванического элемента.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1731; Нарушение авторских прав?; Мы поможем в написании вашей работы!