
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионометрия, ионоселективные электроды, применение
|
|
|
|
Работы в направлении изучения различных типов ионоселективных электродов в последнее десятилетие XX столетия привели к созданию новой области физико-химического исследования – ионометрии. Большие заслуги в развитии теории ионометрии принадлежат советским ученым – академикам Б.П. Никольскому и М.М. Шульцу.
Сотрудниками указанной школы предложены и получены специальные стекла, электроды из которых избирательно реагируют на изменение активности ряда ионов K+, Na+, Ca2+, CI–, Br–,J– и др. (ионоселективные электроды).
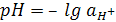 ;
;
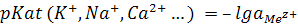 ; (13.6)
; (13.6)
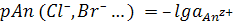 .
.
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС) обратимых гальванических элементов, состоящих из двух электродов, которые могут быть погружены в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, имеющих между собой жидкостный контакт (цепь с переносом).
В настоящее время при исследовании составов растворов широкое практическое применение получили новые методы прямого потенциометрического анализа, объединённые под общим названием "ионометрия". Они основаны на использовании ионоселективных электродов.
Электрод, потенциал которого зависит от активности (концентрации) определённых ионов в растворе, называется индикаторным. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения.
В потенционометрии используют два основных класса индикаторных электродов:
1. Электроды, на межфазных границах которых протекают реакции с участием электронов. Такие электроды называются электронно-обменными.
2. Электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называются мембранными, ионообменными, а также их называют ионоселективными (ИСЭ). Основная часть ИСЭ – мембрана, разделяющая два раствора:
раствор 1 /мембрана/ раствор 2.
Мембрана ИСЭ должна быть проницаема для ионов одного знака заряда и преимущественно для ионов одного вида в присутствии других видов. В соответствии с теорией ионоселективных электродов Никольского (1937) между мембраной и соприкасающимся с ней раствором протекает реакция обмена противоионами, которую можно записать следующим образом:
В+ + А+ ↔ В+ + А+. Например, в Н+ – селективных электродах на границе раздела фаз мембрана/раствор протекает следующая обменная реакция:
Na+ в мембране + Н+ в растворе ↔ Na+ в растворе + Н+ в мембране.
Потенциал данного электрода обусловлен обменом ионов щелочных металлов в стеклянной мембране с ионами водорода из раствора. Энергетическое состояние ионов в стекле и растворе различно. За счёт этого на границе мембрана/раствор возникает разность потенциалов. Реакции соответствует константа равновесия:
Поведение большинства ионоселективных электродов описывается уравнением Нернста, по которому рассчитывают ЭДС элемента, составленного из индикаторного электрода и электрода сравнения. Затем определяется активность анализируемого иона.
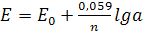 (13.7)
(13.7)
Если в растворе присутствуют другие ионы, мешающие определению, то активность рассчитывается по формуле:
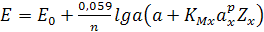 (13.8)
(13.8)
(уравнение Никольского)
где а – активность определяемого иона;
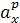 – активность мешающего иона;
– активность мешающего иона;
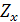 – заряд мешающего иона;
– заряд мешающего иона;
n – заряд определяемого иона;
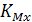 – коэффициент селективного электрода по отношению к определяемому иону на фоне мешающего иона.
– коэффициент селективного электрода по отношению к определяемому иону на фоне мешающего иона.
Если 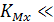 1, то электрод имеет повышенную селективность по отношению к определяемому иону М, а при
1, то электрод имеет повышенную селективность по отношению к определяемому иону М, а при 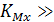 1 селективность отсутствует и оба иона (анализируемый и примесный) влияют на электродный потенциал. Другими словами, коэффициент селективности показывает возможность работы электрода в присутствии мешающих ионов. Чем меньше коэффициент селективности, тем с большей избирательностью по отношению с определяемым ионом в присутствии мешающих ионов работает данный электрод.
1 селективность отсутствует и оба иона (анализируемый и примесный) влияют на электродный потенциал. Другими словами, коэффициент селективности показывает возможность работы электрода в присутствии мешающих ионов. Чем меньше коэффициент селективности, тем с большей избирательностью по отношению с определяемым ионом в присутствии мешающих ионов работает данный электрод.
Стеклянные электроды – старейшие и наиболее распространённые ИСЭ. Начальная стадия их разработки связана с задачами измерения рН растворов. В 50-х г.г. XX были разработаны и начали выпускаться стеклянные электроды с металлическими функциями. В основе теории стеклянного электрода лежит представление, что стекло – это ионообменник, который может вступать в ионообменное взаимодействие с раствором:
А+ + В+ ↔ А+ + В+.
Стёкла, состоящие из оксидов кремния, натрия и кальция, обладают резко выраженным специфическим сродством к ионам. Введение в состав стекла оксидов алюминия и бора в сильной степени сокращают область функции стеклянного электрода. Таким путём удалось создать ионоселективные стеклянные электроды для ионов:
Na+, K+, NH4+, Li+, Ag+, Fe2+, Fe3+.
В лабораторной практике широко применяют электроды с гомогенными мембранами, чувствительные к ионам. В электродных системах с твёрдыми мембранами в качестве чувствительного элемента используют соединения, обладающие ионной или смешанной электронно-ионной проводимостью. Обычно в таких соединениях (LaF3, AgCI, Ag2S, Cu2S) число которых крайне невелико, в процессе переноса заряда участвуют только один из ионов кристаллической решётки, имеющей, как правило, наименьший радиус (ионный) и наименьший заряд. Перенос заряда в таких соединениях происходит за счёт дефектов кристаллической решётки в соответствии с механизмом, при котором вакансии занимаются свободными соседними ионами.
На практике используют также твёрдые гетерогенные электроды, чувствительный элемент которых состоит из активного компонента (те же соединения, что и в гомогенных электродах) и инертного связующего материала (полиэтилен, эпоксидная смола).
В жидкостных ионоселективных электродах возникновение потенциала на границе раздела фаз обусловлено ионным обменом, связанным с различием констант распределения иона между жидкой и органической фазами.
В качестве электродноактивного соединения в жидкостных ионоселективных электродах могут быть использованы хелаты металлов, ионные ассоциаты органических и металлсодержащих катионов и анионов, комплексы с нейтральными переносчиками.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 6027; Нарушение авторских прав?; Мы поможем в написании вашей работы!