
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции первого, второго, третьего и нулевого порядков, их математическое описание
|
|
|
|
Химических реакций
Лекция 15. Кинетические уравнения односторонних
Вопросы для самопроверки
1. Что называется скоростью химической реакции и от каких факторов она зависит?
2. Дайте определение понятий "средняя" и "истинная" скорость химической реакции.
3. Сформулируйте основной постулат химической кинетики (закон действующих масс).
4. Каков физический смысл константы скорости реакции?
5. Что такое молекулярность реакции, моно-, би- и тримолекулярные реакции? Приведите примеры.
6. Что называется порядком реакции, как оценивается порядок по отдельным реагирующим веществам и общий порядок? Всегда ли совпадают молекулярность и порядок реакции?
7. Какие реакции называются псевдомономолекулярными?
8. От чего зависит и от чего не зависит константа скорости химической
реакции?
9. Охарактеризуйте особенность гомогенных и гетерогенных реакций. Из каких основных стадий состоит гетерогенная химическая реакция?
15.1 Реакции первого, второго, третьего и нулевого порядков, их математическое описание.
15.2 Константа скорости и период полураспада химических реакций.
15.3 Способы определения порядка реакций.
Мономолекулярная реакция:
Итак, общий вид уравнения мономолекулярной необратимой химической реакции можно представить так:
А→продукты реакции.
Согласно закону действующих масс, скорость мономолекулярной химической реакции

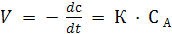 (15.1)
(15.1)
Это кинетическое уравнение реакции первого порядка.
Выражение для расчета константы скорости реакции первого порядка получают интегрируя последнее уравнение в пределах от С0 до С и от
t0=0 до t.
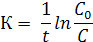
или
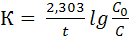 (15.2)
(15.2)
где С0 – начальная концентрация моль/л;
С – концентрация к моменту времени t.
Константа К реакции первого порядка имеет размерность обратного времени–t-1,(с-1, мин-1 и т.д.).
Бимолекулярная реакция:
А+В→продукты реакции
или 2А →продукты реакции
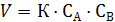
или
 (15.3)
(15.3)
Это кинетическое уравнение реакции второго порядка.
Если  ,
,
 ,
,
 . (15.4)
. (15.4)
Размерность К реакции второго порядка зависит от способа выражения концентрации растворов  .
.
Тримолекулярная реакция:
А+В+С→продукты реакции;
2А+В→продукты реакции;
3А→продукты реакции.
Если  , то скорость реакции:
, то скорость реакции:


Это кинетическое уравнение реакции третьего порядка,
 (15.5)
(15.5)
Размерность К реакции третьего порядка – 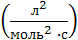 .
.
В реакциях нулевого порядка скорость реакции от концентрации не зависит
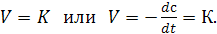 (15.6)
(15.6)
Это имеет место в тех случаях, когда убыль вещества в результате протекания химической реакции восполняется доставкой его по другой фазе. Нулевой порядок наблюдается также, если скорость реакции лимитируется подачей энергии, необходимой для активации реагирующих молекул. Часто в каталитических реакциях скорость определяется концентрацией катализатора и не зависит от концентрации реагирующих веществ.
Интегрирование последнего уравнения дает
 , (15.7)
, (15.7)
откуда видно, что концентрация реагирующего вещества линейно убывает со временем. Размерность К реакции нулевого порядка совпадает с размерностью скорости реакции.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3032; Нарушение авторских прав?; Мы поможем в написании вашей работы!