
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика химических реакций
|
|
|
|
Лекция 14. Химическая кинетика
Вопросы для самопроверки
1. Какие процессы в гальванической цепи могут быть причиной возникновения ЭДС? Какие типы цепей вы знаете?
2. Приведите примеры простых, сложных химических и концентрационных цепей.
3. Напишите электрохимическую схему и рассмотрите принцип работы нормального элемента Вестона.
4. Приведите примеры гальванических цепей с переносом и без переноса
ионов.
5. Как рассчитать ЭДС концентрационной цепи?
6. Как влияет активность KCI на величину электродного потенциала каломельного и хлорсеребряного электродов?
7. Рассмотрите принцип действия стеклянного электрода.
8. Охарактеризуйте гальваническую цепь, которая может быть использована для определения pH среды.
9. Рассмотрите сущность методов потенциометрии и ионометрии, классификацию ионоселективных электродов.
14.1 Кинетика химических реакций.
14.2 Скорость химических реакций, влияние природы реагирующих веществ на скорость реакций.
14.3 Основной постулат химической кинетики, закон действующих масс.
14.4 Молекулярность и порядок химических реакций.
Химическая кинетика изучает закономерности протекания во времени и механизм химических реакций, а также зависимость скорости химических реакций от различных факторов: концентрации реагирующих веществ, давления, температуры, воздействия проникающего излучения, присутствия катализаторов и т.д.
Следует отметить особую важность вопросов химической кинетики для изучения биологических систем: они неравновесны, имеют кинетические ограничения, протекают с малыми скоростями (гидролиз полисахаридов, белков, нуклеиновых кислот и др.).
Кинетические исследования позволяют глубже понять:
а) механизмы регулирования скорости химических процессов;
б) действие ферментов и ингибиторов на скорость реакций;
в) протекание фотохимических и цепных реакций.
Все реакции, рассматриваемые в химической кинетике, делятся на гомогенные и гетерогенные. Гомогенные химические реакции – процессы, протекающие в одной фазе (любая химическая реакция в растворе или газовой среде, реакция горения природного газа в воздухе и др.).
Гетерогенные химические реакции – это процессы, протекающие на поверхности раздела фаз:
2SO2 + О2 → 2SO3 на твердом катализаторе,
3H2+N2 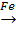 2NH3 на твердом катализаторе.
2NH3 на твердом катализаторе.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 794; Нарушение авторских прав?; Мы поможем в написании вашей работы!