
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов, теория электролитической диссоциации Аррениуса
|
|
|
|
Лекция 9. Растворы электролитов
Вопросы для самопроверки
1. Какие свойства растворов называются коллигативными?
2. Объясните понятия «понижение температуры замерзания растворов» и «повышения температуры кипения».
3. Поясните фазовую диаграмму воды.
4. Сформулируйте второй закон Рауля, представьте его математическое выражение.
5. Как можно экспериментально определить и теоретически рассчитать криоскопическую и эбулиоскопическую постоянную?
6. Как рассчитать молярную массу растворенного вещества по второму закону Рауля?
7. Что такое осмотическое давление, как его можно измерить и каким закономерностям оно подчиняется в разбавленных растворах неэлектролитов и электролитов?
8. Что называется прямым и обратным осмосом?
9. Рассмотрите биологическое значение осмотического давления.
10. Будут ли 5%-ные (по массе) растворы сахарозы и глюкозы изоосмотическими при одинаковой температуре?
9.1 Растворы электролитов, теория электролитической диссоциации Аррениуса
9.2 Понятие об активности электролитов, ионов и коэффициентах активности
9.3 Ионная сила раствора
9.4 Теория растворов сильных электролитов Дебая-Хюккеля
Вещества, подвергающиеся при взаимодействии с растворителем диссоциации на ионы и сообщающие раствору способность проводить электрический ток, называются электролитами.
Шведский ученый С. Аррениус предположил, что молекулы электролитов в растворе самопроизвольно распадаются на ионы, хотя подобные идеи были высказаны ранее Гротгусом (1805), а позднее Каяндером, сотрудником Менделеева (1881). Количественная теория электролитической диссоциации Аррениуса (1883-1887) первоначально включала три постулата:
1) при растворении в воде молекулы электролитов распадаются на положительные и отрицательные ионы;
2) процесс электролитической диссоциации – это обратимый процесс, протекающий в прямом и обратном направлениях;
3) сумма положительных электрических зарядов катионов равна сумме отрицательных зарядов анионов.
Согласно теории Аррениуса, силы взаимодействия между ионами в растворе отсутствуют (подобно газовым системам). Аррениус не рассматривал причин электролитической диссоциации. Он считал раствор механической смесью ионов и молекул, не учитывал ион-дипольные и ион-ионные взаимодействия. Поэтому теорию Аррениуса долго не признавали. Позднее в теорию электролитической диссоциации были введены представления о сольватации и гидратации ионов (Каблуков). Сольватация – это взаимодействие частиц растворенного вещества с молекулами растворителя (в случае воды имеет место гидратация).
По способности к электролитической диссоциации электролиты условно разделяют на две группы:
1) слабые электролиты – в присутствии их в растворе диссоциирует на ионы незначительная часть молекул (органические кислоты, фенолы, амины, аммиак, угольная кислота, некоторые соли (HgCI2) и др.)
2) сильные электролиты – в присутствии их в растворе диссоциирует на ионы большая часть молекул (сильные минеральные кислоты, сильные основания, большинство неорганических солей).
Однако следует заметить, что это деление электролитов условно и в значительной степени зависит от природы растворителя. Более строгое различие электролитов можно сделать на основании анализа зависимости электропроводности их растворов от концентрации.
Одной из важнейших количественных характеристик электролита в растворе является степень электролитической диссоциации
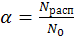 ; (9.1)
; (9.1)
которую можно определить как отношение числа молекул, распавшихся на ионы, к общему числу молекул электролита в растворе. Однако по величине α судить о силе электролита не очень удобно, т.к. она зависит от многих параметров (в том числе и от концентрации растворов). Более удобно использовать для этих целей Кдис (константу диссоциации или ионизации) электролитов. Выражение Кдис. для бинарного электролита на примере уксусной кислоты можно получить путем несложных рассуждений в виде:
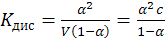 (9.2)
(9.2)
где V – разведение раствора электролита, л/моль.
Для растворов слабых электролитов, когда α << 1, Кдис. ≈ α2С.
Последняя формула является математическим выражением закона разведения Оствальда (1888). Константа диссоциации – удобная мера оценки силы электролита, однако она зависит от температуры.
В растворах сильных электролитов наблюдается отклонение от закона разведения Оствальда. Причина отклонения – полная диссоциация молекул электролита на ионы.
В растворах сильных электролитов за счет диссоциации молекул на
ионы общее число частиц возрастает по сравнению с растворами неэлектролитов и их коллигативные свойства изменяются. Поэтому в рассмотренные ранее формулы первого и второго законов Рауля, уравнение Вант-Гоффа для растворов электролитов вводится поправка i (изотонический коэффициент).
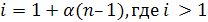
I закон Рауля 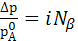
II закон Рауля 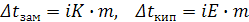 (9.3)
(9.3)
Уравнение Вант-Гоффа 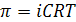 .
.
Свойства растворов сильных электролитов (понижение давления пара, понижение температуры замерзания, повышение температуры кипения
растворов) оказываются большими по сравнению со свойствами неэлектролитов. Например, вода соленых водоемов испаряется меньше и замерзает при более низкой температуре, чем пресноводных водоемов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 611; Нарушение авторских прав?; Мы поможем в написании вашей работы!