
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение двухкомпонентных ферментов
|
|
|
|
Основой двухкомпонентного фермента, как и однокомпонентного, является молекула белка, которую в данном случае называют апоферментом, а небелковую часть фермента принято называть коферментом. Коферменты образуются из витаминов, нуклеотидов и других активных группировок, включающих атомы металлов, серы, а также различные органические соединения (гетероциклические радикалы пиррола и имидазола, хиноны, липоевая кислота, кетокислоты и др.).
Известны многие ферменты, у которых атомы металлов соединены непосредственно с аминокислотными остатками, формирующими каталитический центр.
Коферменты имеют разные формы соединения с белковой частью фермента. Одни из них довольно легко отделяются от фермента и могут самостоятельно участвовать в биохимических реакциях, другие связаны с ферментным белком очень прочно и не могут быть выделены без разрушения молекулы фермента. Коферменты, прочно связанные с ферментным белком, часто называют простетическими группами. К наиболее хорошо изученным простетическим группам относятся биотин, липоевая кислота, флавиновые коферменты и железосодержащие коферменты - гемы. Рассмотрим в качестве примеров флавиновые и железосодержащие коферменты.
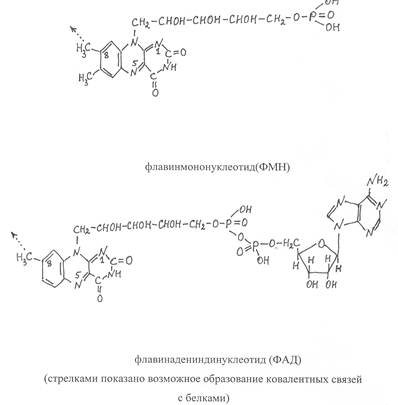
Флавиновые простетические группы представлены двумя видами соединений – флавинадениндинуклеотидом (ФАД) и флавинмононуклео-тидом (ФМН), которые ковалентно связаны с ферментными белками.
Коферментная группировка ФМН представляет собой витамин рибофлавин, фосфорилированный по спиртовой группе пятого углеродного атома рибита, а в составе ФАД к ФМН путем взаимодействия фосфатных остатков присоединяется нуклеотидный радикал аденозин-монофосфата (АМФ). Чаще всего флавиновая простетическая группа соединяется с ферментным белком путем образования ковалентной связи между углеродом метильной группы, соединенной с восьмым углеродным атомом диметилизоаллоксазина, и азотом гетероциклического радикала гистидина или атомом серы цистеинового отатка в составе белка.
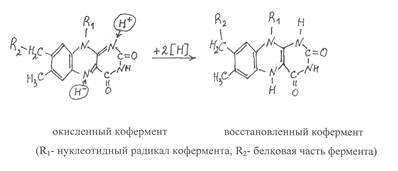
Каталитическая активность указанных простетичеких групп проявляется в том, что они способны присоединять атомы водорода к атомам азота диметилизоаллоксазина в положениях 1 и 5 с последующей перегруппировкой двойных связей. В результате присоединения атомов водорода флавиновый кофермент превращается в восстановленную форму, которая сокращенно записывается ФАД·Н2 или ФМН·Н2, а окисленная форма соответственно - ФАД и ФМН.
 |
При этом считается, что один атом водорода отщепляется от субстрата в виде протона (Н+), а другой – в виде гидрид-иона (Н‾). В процессе взаимодействия с флавиновым коферментом протон присоединяется к атому азота диметилизоаллоксозина в положении 1, а гидрид-ион – к атому азота в положении 5. В виде таких же ионных форм происходит отщепление водорода и от восстановленного флавинового кофермента.
В настоящее время известны несколько десятков ферментов, имеющих флавиновые коферменты. Они могут функционировать в качестве переносчиков водорода в дыхательных реакциях и катализируют многие реакции окисления: спиртов в альдегиды, дигидролипоевой в липоевую кислоту, гликолевой кислоты в глиоксиловую. С участием флавиновых ферментов происходит образование α,β-ненасыщенных производных жирных кислот и превращение янтарной кислоты в фумаровую.
 |
У некоторых флавиновых ферментов в активном центре наряду с флавиновым коферментом имеются атомы металлов. Так, например, ксантиноксидаза некоторых микроорганизмов, являющаяся димерным белком, содержит в каждой субъединице флавиновый кофермент в виде ФАД, один атом Мо и 4 атома Fe.
Важные функции в организмах выполняют ферменты, имеющие в своем составе простетические группы в виде гема. Гемы представляют собой устойчивые хелатные комплексы порфириновой группировки с атомом железа. Порфириновая группировка образуется из четырех гетероциклических структур пиррола (обозначаемых А, В, С, D), соединенных метеновыми радикалами (=СН-) в более крупную циклическую группировку, к которой присоединены еще восемь боковых радикалов. В зависимости от строения этих радикалов различают разные типы гемов (протогем, гем а, гем c и др.).
При соединении со специфическим белком гем может выполнять роль переносчика электронов или кислорода, катализировать окислительно-восстановительные реакции с участием кислорода или пероксида водорода.
Гемопротеиды, участвующие в переносе электронов, получили название цитохромов. Все они представляют собой сравнительно низкомолекулярные белки, имеющие в качестве простетической группы гем, прочно связанный с молекулой белка. Цитохромы, различающиеся строением гема и белковой молекулы, обычно обозначают латинскими буквами а, в, с, d, f.
Активным компонентом в структуре гема, принимающим участие в переносе электронов, является атом железа. В окисленном цитохроме железо содержится в виде Fe3+, а после присоединения электрона оно превращается в восстановленную форму Fe2+: цит (Fe3+) + `е ® цит (Fe2+).
Восстановленный цитохром передает электрон другому акцептору, превращаясь в окисленную форму, способную снова присоединять электрон от донора:
цит (Fe2+) + акцептор ® цит (Fe3+) + восстановленный акцептор
Наиболее хорошо изучено строение цитохрома c, который представляет собой водорастворимый белок, включающий 104 аминокислотных отатка. Как показали структурные исследования, при формировании третичной структуры цитохрома c пептидная цепь белка,укладывается вокруг гема и образует своеобразную оболочку, которая защищает его от воздействия внешнего раствора. В структуре фермента атом железа образует координационные связи с азотом гетероциклического радикала гистидина, находящегося в положении 18 первичной структуры белка, и атомом серы метионина в положении 80.
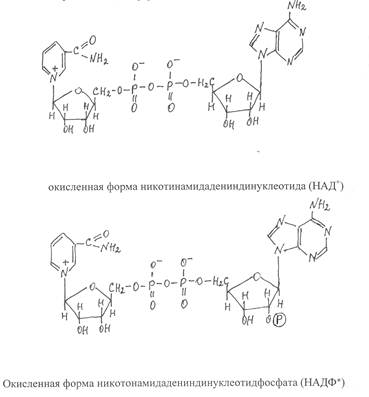
К числу коферментов, которые связаны с белковой частью фермента лабильными связями, относятся никотинамидадениндинуклеотид (НАД), никотинамидадениндинуклеотидфосфат (НАДФ), кофермент А (КоА), а также коферментные формы витаминов В1, В6, В12, фолиевой кислоты. Эти коферменты удерживаются в активном центре ферментов водородными связями и силами электростатического взаимодействия заряженных группировок кофермента и функциональных групп аминокислотных остатков, образующих активный центр фермента. В связи с этим указанные коферменты легко отделяются от белковой части фермента.
Большое число ферментов имеют в качестве кофермента динуклеотидную группировку НАД. Молекулы кофермента НАД образуются из витамина РР (амид никотиновой кислоты) и нуклеотида АМФ (аденозинмонофосфат), соединенных через остатки ортофосфорной кислоты и по химическому строению представляют собой динуклеотиды. НАДФ отличается от НАД только наличием дополнительной фосфатной группировки, присоединенной ко второму атому углерода рибозы в составе АМФ.
Ферменты, имеющие в своем составе НАД и НАДФ, катализируют реакции отщепления водорода от восстановленных субстратов и перенос их на соответствующий акцептор. Очень часто таким акцептором является окисленный флавиновый кофермент.
 |
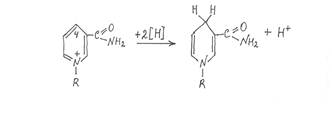
Активной группировкой, участвующей в отщеплении и переносе водорода, служит окисленная форма никотинамида. Исследователи считают, что от субстрата отщепляются два атома водорода в виде гидрид-иона (Нˉ) и протона (Н+), при этом гидрид-ион присоединяется к четвертому углеродному атому никотинамида в составе фермента, переводя его в восстановленную форму, а протон не связывается с коферментом и в дальнейшем непосредственно переходит на акцептор, с которым взаимодействует восстановленный кофермент, передавая на акцептор два электрона и водород в виде гидрид-иона (Нˉ).
Окисленную форму НАД принято сокращенно записывать в виде НАД+, а восстановленную - НАД×Н. Соответственно окисленная форма НАДФ записывается НАДФ+, восстановленная - НАДФ×Н. Поскольку в
 |
НАД⁺ НАД·Н₂
реакциях, катализируемых НАД- и НАДФ- содержащими ферментами, происходит отщепление водорода от субстратов, то такие ферменты называют дегидрогеназами. Схематически действие дегидрогеназы, имеющей кофермент НАД, можно представить следующим образом:
субстрат-Н₂ + НАД+–фермент¾®субстратокисл + фермент–НАД×Н + Н+
фермент–НАД ×Н +Н+ + акцептор ¾® НАД+–фермент + акцептор–Н₂
НАД и НАДФ очень легко отделяются от ферментного белка и могут существовать в свободной форме, диффундируя от одного фермента к другому. Свободные формы этих коферментов могут также переноситься по флоэмной системе растений от донорных клеток и органов к акцепторным.
НАД – зависимые ферменты наиболее активны в ускорении реакций, связанных с отщеплением водорода от субстратов, а ферменты, имеющие восстановленные коферменты НАДФ, чаще всего используются как сильные восстановители.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 930; Нарушение авторских прав?; Мы поможем в написании вашей работы!