
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
К вопросу электронного строения атома
|
|
|
|
Учебный материал и обучающие задачи
Практическое занятие № 1
Тема: Электронное строение элементов-органогенов. Химическая связь в органических соединениях. Изомерия. Номенклатура.
Цель: Закрепить на основе школьного курса представления об электронном строении атома, гибридизации атомных орбиталей и химической связи как базовом материале для изучения биоорганической химии. Сформировать знания основных правил международной номенклатуры и умения использовать их в названиях органических соединений, являющихся объектом изучения биоорганической химии.
Исходный уровень: Из школьного курса необходимо знать:
1. Основные положения теории строения органических соединений А.М. Бутлерова. Изомерия (структурная; цис-транс-изомерия).
2. Электронное строение атома. Гибридизация атомных орбиталей (АО).
3. Ковалентная связь как основной вид связи в органических соединениях и ее параметры.
4. Основные правила международной номенклатуры ИЮПАК отдельных классов органических соединений – углеводородов, спиртов, альдегидов, карбоновых кислот, аминокислот.
Содержание занятия:
1. Практическая часть. Электронное строение атомов, химическая связь, изомерия, номенклатура.
1.1. Электронное строение элементов-органогенов.
1.2. Типы гибридизации АО.
1.3. Химическая связь и ее параметры: механизм образования, меры прочности, направленность (s- и p-связь), полярность, поляризуемость.
1.4. Принципы международной номенклатуры ИЮПАК.
1.5. Изомерия.
2. Контроль усвоения темы.
Согласно современным представлениям атом – нейтральная делимая частица, в центре которой находится положительно заряженное ядро. Заряд ядра равен порядковому номеру элемента и числу электронов вокруг ядра.
Электрон ( ) имеет заряд –1 и обладает одновременно свойствами волны и частицы. С точки зрения квантовой механики нельзя дать строго координаты электрона в атоме, а можно говорить только о пространстве его наиболее вероятного нахождения вокруг ядра, которое называется атомной орбиталью (АО).
) имеет заряд –1 и обладает одновременно свойствами волны и частицы. С точки зрения квантовой механики нельзя дать строго координаты электрона в атоме, а можно говорить только о пространстве его наиболее вероятного нахождения вокруг ядра, которое называется атомной орбиталью (АО).
Формы АО: 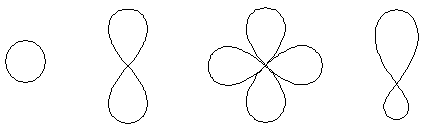
s-АО p-АО d-АО гибридная АО
Заполнение электронами АО подчиняется трем основным правилам.
Принцип Паули. Каждый электрон в атоме имеет свое энергетическое состояние (в атоме нет двух одинаковых электронов).
Чем же электроны в атоме могут различаться?
1) Запасом энергии (Е). По запасу Е все электроны в атоме распределяются по энергетическим уровням или электронным слоям.
Номер уровня обозначают n = 1, 2, 3, …
Самый малый запас Е у электронов первого уровня.
2) Внутри уровня электроны различаются формой АО и по этому признаку объединяются в подуровни: s-, p-, d-, f-.
На первом уровне – только s-подуровень; на 2-ом – s- и p-; на 3-ем – s-, p- и d-; на 4-ом – s-, p-, d- и f-.
3) Внутри подуровня электроны различаются расположением АО в пространстве. По этому признаку определяется количество АО на подуровне:
s-подуровень – 1 АО; p-подуровень – 3 АО (px, py, pz); d-подуровень – 5 АО,
f-подуровень – 7 АО.
4) На данной АО электроны отличаются друг от друга направлением вращения вокруг собственной оси (спином) и их может быть только два: один – по часовой, а другой – против часовой стрелки.
Принцип наименьшей Е. Электроны в атоме заполняют вначале наиболее энергетически выгодные АО: 1s < 2s < 2p < 3s < 3p < 4s < 3d… Таким образом d-подуровни энергетически невыгодны и заполняются после s-подуровня вышестоящего уровня.
Правило Гунда. Электроны располагаются на АО так, чтобы сохранялось наибольшее число электронов с параллельными спинами, т.е. поодиночке.
В ПСЭ все элементы по заполнению подуровней делятся на блоки: s-, p-, d-… Для s- и p-элементов число электронов на внешнем уровне равняется номеру группы; для d-элементов – сумме электронов с внешнего s- и предвнешнего d-подуровня. Эти электроны называются валентными, так как могут принимать участие в образовании химической связи.
Валентность – число связей, которые дает атом в данном состоянии.
Задача № 1. Показать электронное состояние атома углерода и возможные валентности.
|
С – элемент II периода и его 6 электронов распределяются по двум энергетическим уровням.
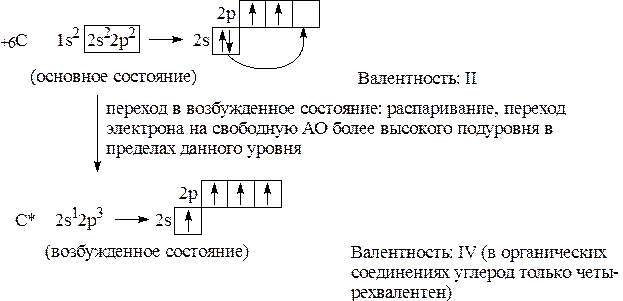
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 862; Нарушение авторских прав?; Мы поможем в написании вашей работы!