
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
К вопросу химической связи
|
|
|
|
Гибридизация атомных орбиталей на примере углерода
Гибридизация – процесс выравнивания АО по форме и энергии. Гибридизация возможна в тех случаях, когда число неспаренных электронов в основном состоянии атома меньше общего числа электронов на валентном уровне (C, Si, N, P, S, O, …).
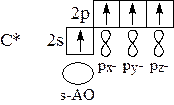 sp 3-гибридизация:
sp 3-гибридизация:

sp 2-гибридизация:
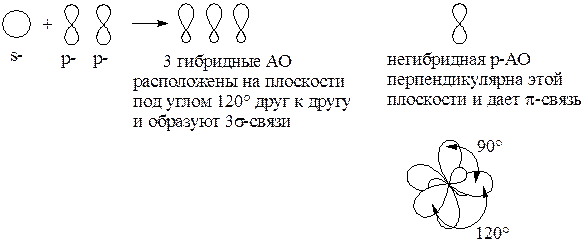
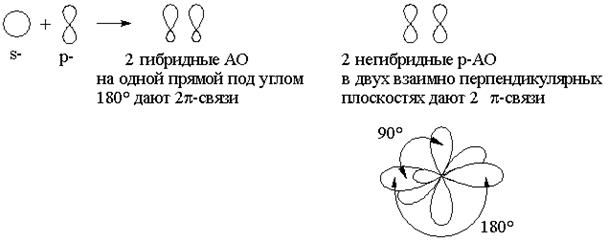
sp -гибридизация:
|
По методу «валентных связей» (ВС) основной вид химической связи – ковалентная.
Ковалентная связь осуществляется образованием общих электронных пар между связываемыми атомами.
Механизм образования ковалентной связи заключается в перекрывании АО неспаренных электронов с противоположными спинами (обменный механизм образования ковалентной связи). Например: образование молекулы Н2.
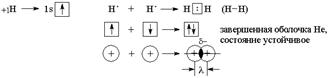 |
Область перекрывания (d-) притягивается ядрами обоих атомов и за счет электрических сил притяжения существует молекула.
Кроме обменного, существует донорно-акцепторный механизм образования ковалентной связи. В этом случае связь возникает за счет перекрывания заполненной АО одного атома (донор) и свободной АО другого (акцептор). Например: образование катиона аммония.

Мерой прочности ковалентной связи являются энергия связи (Есв.) и длина связи (l).
Есв. - это энергия, которая выделяется при образовании связи или необходимая для ее разрыва.
l - расстояние между ядрами связанных атомов. Чем короче, тем связь прочнее.
По направлению перекрывания АО электронов, образующих связь, различают s- (сигма) и p- (пи) связь.
s-Связь (осевое перекрывание): АО перекрываются вдоль оси, соединяющей центры атомов. s-Связь дают все виды АО: s-, p-, d- и гибридные.
p-Связь (боковое перекрывание) дают только негибридные p-АО. Область перекрывания располагается по обе стороны от прямой, связывающей ядра атомов.
p-Связь менее прочная, чем s-связь, так как электроны p-связи находятся дальше от ядер связываемых атомов и меньше ими удерживаются.
Ковалентная связь может быть полярной или неполярной. Полярность обусловлена смещением электронов связи в сторону более электроотрицательного атома.
Электроотрицательность (ЭО) – способность атома удерживать валентные электроны. Самый электроотрицательный атом – фтор.
Поляризуемость – способность ковалентной связи становиться полярной под действием внешнего электрического поля, например, реагента.
Поляризуемость в большей степени, чем полярность, влияет на реакционную способность вещества.
p-Связь легче поляризуется, чем s-связь.
В настоящее время общепринята систематическая номенклатура ИЮПАК или международная (IUPAC – международный союз теоретической и прикладной химии), а также широко применяются и тривиальные названия. Принципы международной номенклатуры органических соединений
1. Выбрать старшую функциональную группу (по таблице). В названии соединения старшую группу называют в суффиксе.
| Функциональная группа | Префикс | Суффикс | Класс соединений |

| - | -овая кислота | карбоновые кислоты |

| оксо | -аль | альдегиды |

| оксо | -он | кетоны |
| -ОН | гидрокси | -ол | спирты |
| -SH | меркапто | -тиол | тиоспирты |
| -NH2 | амино | амин | амины |
2. Выбрать родоначальную структуру (исходный незамещенный углеводород, название которого – корень названия соединения).
Критерии выбора:
родоначальная структура должна включать:
- старшую функциональную группу;
- максимальное число функциональных групп;
- максимальное число кратных связей;
- должна иметь максимальную длину.
3. Нумеруют атомы углерода родоначальной структуры так, чтобы старшая функция получила минимальный номер.
4. Перечисляют в приставке (префиксе) названия заместителей с указанием местоположения.
Образцы решения задач
Задача № 2. Дать название молочной кислоты по международной номенклатуре
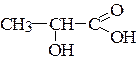
Решение.
1) Из двух функциональных групп старшей является карбоксильная группа, называемая в суффиксе: -овая кислота.
2) Родоначальная структура – цепь из трех атомов углерода, корень названия – п р о п а н.
3) Нумеруем атомы углерода цепи:

4) В префиксе даем название младшей функциональной группы -ОН (гидрокси) с указанием местоположения.
Записываем название соединения:
2-гидроксипропановая кислота.
Задача № 3. Указать тип гибридизации атомов углерода в молекуле пропена.
Решение:
пропен 
Задача № 4. Указать s- и p-связи в молекуле муравьиной кислоты.
Решение: все одинарные связи – s;
двойная связь – (s + p);
тройная связь – (s + p + p).
муравьиная кислота 
Задача № 5. Указать первичные (перв), вторичные (втор), третичные (трет), четвертичные (ч) атомы углерода в молекуле 2,2,4-триметилпентана.
Решение: Первичный атом С связан с одним соседним атомом С;
Вторичный атом С связан с двумя соседними атомами С;
Третичный атом С связан с тремя соседними атомами С;
Четвертичный атом С связан с четырьмя соседними атомами С.

Задача № 6. Написать структурные формулы всех изомеров состава С3Н6О. Назвать соединения.
Решение:
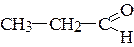 пропаналь, пропионовый альдегид (класс: альдегиды)
пропаналь, пропионовый альдегид (класс: альдегиды)
 пропанон-2, ацетон (класс: кетоны)
пропанон-2, ацетон (класс: кетоны)
 пропен-2-ол-1, аллиловый спирт (класс: непредельные спирты
пропен-2-ол-1, аллиловый спирт (класс: непредельные спирты
Вопросы для самостоятельной работы по теме «Электронное строение элементов-органогенов. Химическая связь в органических соединениях. Изомерия. Номенклатура»
1. Покажите электронное строение элементов-органогенов (C, N, H, O, S, P) в основном и возбужденном состояниях с указанием возможной валентности.
2. Укажите тип гибридизации атома углерода в следующих соединениях:
а) CH4; б) СН2=СН2; в) СН3-СН=СН-СН3; г) СН2=СН-СН=СН2;
д) СН2=СН-СН3; е) 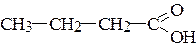 ; ж) CH3-CºN;
; ж) CH3-CºN;
з) 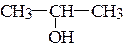 ;
;
и) 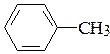
Назовите соединения.
3. Покажите s- и p-связь в соединениях. Назовите соединения.
а) CH3-CH=CH2; б) СНºС-СН2-СН3; в)  ; г)
; г)  ;
;
д) 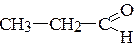
4. Покажите направление смещения s-связи в соединениях. Назовите соединения.
а) CH3-I; б) CH3-CH2-OH; в)  ; г) Br-CH2-CH3;
; г) Br-CH2-CH3;
д) CH3-NH2; е)  ; ж)
; ж)  ; з)
; з)  ; и)
; и) 
5. Покажите образование донорно-акцепторной связи на примере иона оксония Н3О+.
6. Водородная связь: определение, механизм образования, типы, биороль. Покажите образование водородной связи между молекулами:
а) этанола и воды; б) метанола; в) урацила.
7. Укажите первичные, вторичные, третичные и четвертичные атомы углерода в соединениях. Назовите соединения.
а) CH3-CH2-CH3; б) 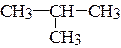 ; в)
; в)  ;
;
г) 
8. Изомерия. Изомеры. Виды изомерии. Напишите структурные формулы всех возможных изомеров состава: а) С4Н8; б) С3Н8О; в) С9Н12 (гомологи бензола). Назовите соединения.
9. Правила международной номенклатуры ИЮПАК.
9.1. Название a-аминокислоты метионина по международной номенклатуре: 2-амино-4-метилтиобутановая кислота. Напишите структурную формулу метионина.
9.2. В качестве заменителя сахара для больных диабетом используют ксилит, название которого по международной номенклатуре: пентанпентаол‑1,2,3,4,5. Напишите структурную формулу ксилита и определите, к какому классу соединений он относится.
9.3. Для кратковременного наркоза применяется 1,1,2-трихлорэтен. Напишите структурную формулу этого соединения и укажите, к какому классу оно относится.
9.4. Назовите по международной номенклатуре акролеин СН2=СН-СНО и алифатический амин С2Н5-NH2.
9.5. В основе одной из групп жаропонижающих и болеутоляющих средств лежит 4-аминофенол. Напишите его структурную формулу и назовите функциональные группы.
9.6. Назовите по международной номенклатуре соединения:
а) НООС-СН2-СН2-СООН; б) H2N-CH2-CH2-CH2-COOH;
в) HSCH2CH(NH2)COOH; г) СН3-СН=СН-СООН;
д) НООС-СН2-СН2-СН(NH2)COOH; е) НООС-СНО.
9.7. Покажите с помощью структурных формул строение соединений:
а) 2-бром-1,1,1-трифтор-2-хлорэтана; б) транс-бутендиовой кислоты;
в) этандиаля; г) трийодметана; д) пропантиола-1;
е) 2-оксопентандиовой кислоты.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1363; Нарушение авторских прав?; Мы поможем в написании вашей работы!