
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторно-практическое занятие № 4
|
|
|
|
Тема: Кислотность и основность по Бренстеду. Гидроксисоединения.
Цель: 1. Сформировать знания кислотности и основности органических соединений как важнейших свойств, определяющих большинство химических реакций в живых организмах.
2. Выработать умение прогнозировать реакционную способность спиртов в зависимости от их строения и строения реагентов.
Исходный уровень:
1. Электроотрицательность атомов по Полингу.
2. Электронные эффекты заместителей. ЭА и ЭД.
3. Электронное строение пиррольного и пиридинового атомов азота.
4. Классификация реакций по их механизму. Типы реагентов.
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Кислотность и основность по Бренстеду. Гидроксисоединения».
2.1. Кислотность и основность по Бренстеду. Сравнительная характеристика кислотных свойств спиртов, тиолов, фенолов и карбоновых кислот.
2.2. Роль неподеленной пары электронов гетероатомов в проявлении основных свойств аминов, эфиров, тиоэфиров и спиртов.
2.3. Реакционная способность спиртов.
3. Лабораторная работа по теме «Гидроксисоединения».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Важными аспектами реакционной способности органических соединений являются их кислотные и основные свойства. Перенос протона, например, между атомами кислорода, азота и серы наблюдается в ходе многих биохимических реакций. Большую роль в биохимических процессах также играет кислотный или основной катализ.
Для оценки кислотности и основности органических соединений часто используют теорию Бренстеда. Понятия «кислоты и основания Бренстеда» будут использоваться практически во всех последующих темах.
Вопросы для самостоятельной работы
«Кислотность и основность органических соединений»
1. Дайте определение кислоты и основания по Бренстеду (Б.).
2. Покажите протолитическую реакцию переноса Н+ от кислоты Б. к Н2О как основанию. Введите понятие сопряженной кислоты и сопряженного основания.
3. На примере HCl и HCN сравните силу кислоты Бренстеда и сопряженного ей основания.
4. Дайте определение кислотного центра (к.ц.) и покажите классификацию кислот Б. по кислотному центру.
5. Что такое Ка и рКа?
6. Поясните, почему по устойчивости аниона судят о силе кислоты.
7. Перечислите факторы, от которых зависит стабильность аниона (сила кислоты Б.).
8. Выделите кислотный центр в соединениях и составьте ряд возрастания кислотности. Объясните причину изменения кислотных свойств.
а) С2Н5-СН3; б) С2Н5-ОН; в) C2H5-NH2
9. Объясните и подтвердите реакциями различие в кислотных свойствах спиртов и тиолов:
рКа (С2Н5ОН) = 18,0; рКа (C2H5SH) = 10,5.
Покажите биороль тиолов и применение их в медицине.
10. Сравните кислотность предложенных соединений по рКа, укажите фактор, объясняющий изменение кислотности.
а) С2Н5ОН; б) 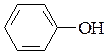 ; в)
; в) 
рКа = 18,0 рКа = 9,9 рКа = 4,7
Изобразите графически феноксид- и карбоксилат-ионы.
11. Покажите влияние заместителей (графически изобразите электронные эффекты) на кислотность соединений.
а) 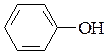 ; б)
; б)  ; в)
; в) 
фенол п -метилфенол п -нитрофенол
рКа = 9,9 рКа = 10,1 рКа = 7,1
12. Объясните различие в кислотности этанола (рКа = 18,0) и этандиола-1,2
(рКа = 15). Подтвердите реакцией (опыт 2).
13. Покажите классификацию оснований Б. по основному центру (о.ц.) и дайте факторы, влияющие на силу основного центра.
14. Напишите протолитическую реакцию переноса протона от воды к основанию. Дайте понятие рКВН+.
15. Выделите основный центр в соединениях:
а)  ; б)
; б) 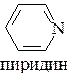 ; в)
; в)  ; г)
; г)  ;
;
д) 
16. Объясните разницу в основности соединений. Отметьте электронные эффекты графически.
а) CH3-NH2; б) CH3-NH-CH3; в) 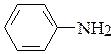 ; г)
; г) 
метиламин диметиламин анилин пиридин
рКВН+ = 10,6 рКВН+ = 10,8 рКВН+ = 4,58 рКВН+ = 5,23
17. Выделите кислотный и основный центры имидазола  . Какими свойствами он обладает? Покажите возможность межмолекулярного взаимодействия за счет образования водородных связей.
. Какими свойствами он обладает? Покажите возможность межмолекулярного взаимодействия за счет образования водородных связей.
18*. Укажите кислотные центры и расположите их в порядке возрастания. Ответ поясните.
а)  – тирозин (a-аминокислота)
– тирозин (a-аминокислота)
б) 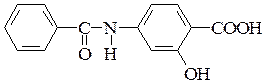 – п -бензиламиносалициловая кислота
– п -бензиламиносалициловая кислота
(п -бензиламиносалициловая кислота в виде кальциевой соли – препарат бепаск – применяется для лечения туберкулеза)
19*. Объясните причину легкой растворимости сульфацила в щелочи. Покажите схему взаимодействия.
 – сульфацил
– сульфацил
20*. Выделите основные центры, укажите место протонирования. Покажите биологическую роль этих соединений.
а) 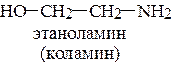 ; б)
; б) 
21*. Является ли холин аммониевым основанием? Поясните. Покажите биороль холина.
22*. Новокаинамид и анестезин применяются в медицине в виде водорастворимых гидрохлоридов. Напишите схему взаимодействия:
а) 
новокаинамид (при сердечной аритмии)
б) 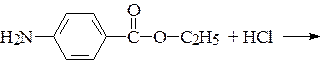
анестезин (для местной анестезии)
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1035; Нарушение авторских прав?; Мы поможем в написании вашей работы!