
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторно-практическое занятие № 6
|
|
|
|
Вопросы к зачету по теме «Оксосоединения».
Тест № 5
1. Метаналь и формальдегид – это
| 1) гомологи | 3) одно и то же вещество |
| 2) структурные изомеры | 4) вещества разных классов |
2. При взаимодействии ацетилена (С2Н2) с водой в присутствии HgSO4 образуется
| 1) этандиол-1,2 | 3) уксусный альдегид |
| 2) этанол | 4) уксусная кислота |
3. Уксусный альдегид реагирует с каждым из двух веществ
| 1) аммичным раствором оксида серебра (I) и кислородом |
| 2) гидроксидом меди(II) и оксидом кальция |
| 3) гидроксидом цинка и водородом |
| 4) соляной кислотой и водой |
4. При взаимодействии ацетальдегида с водородом образуется
| 1) ацетилен | 3) уксусная кислота |
| 2) этиленгликоль | 4) этанол |
5. При окислении пропаналя образуется
| 1) пропанол -1 | 3) пропанон |
| 2) пропановая кислота | 4) пропанол-2 |
6. Основания Шиффа – это продукты взаимодействия оксосоединений и
| 1) спиртов | 3) воды |
| 2) кетонов | 4) аминов |
7. Метаналь может взаимодействовать с
| 1) Cu(OH)2 | 3) CH3C6H5 |
| 2) HBr | 4) CH3COOH |
8. Спирты при взаимодействии с альдегидами образуют
| 1) полуацетали | 3) имины |
| 2) сложные эфиры | 4) соли |
9. Полностью гидратировано оксосоединение
| 1) ацетон | 3) формальдегид |
| 2) хлораль | 4) ацетальдегид |
10. Пропанон образуется в результате реакции
| 1) гидратации пропена | 3) окисления пропанола-2 |
| 2) восстановления пропаналя | 4) окисления пропанола-1 |
1. Альдегиды и кетоны. Реакции нуклеофильного присоединения воды, спиртов, первичных аминов и их производных. Влияние электронных и пространственных факторов, роль кислотного катализа.
2. Напишите уравнение реакции гидратации трихлоруксусного альдегида (хлораля). По какому механизму проходит эта реакция? Какой из альдегидов – уксусный или трихлоруксусный – гидратируется легче и почему? Медицинское применение хлоральгидрата.
3. Напишите уравнение реакции этаналя с метанолом. Опишите механизм с использованием кислотного катализа на стадии образования ацеталя из полуацеталя.
4. Напишите уравнение реакции взаимодействия пропаналя с метиламином. По какому механизму она протекает? Биороль оснований Шиффа.
5. Покажите реакции альдольной конденсации и альдольного расщепления, их биороль.
6. Реакции окисления и восстановления альдегидов и кетонов на примере ацетальдегида и ацетона.
7. Качественные реакции на альдегидную группу:
а) «серебряное зеркало»;
б) «медное зеркало».
8. Формальдегид, строение, физиологическое действие. Напишите реакцию диспропорционирования формальдегида.
9. Ацетон, строение, физиологическая активность. Напишите йодоформную реакцию на ацетон.
10. Уротропин, его медицинское применение. Напишите уравнение реакции получения уротропина.
Тема: Карбоновые кислоты и их функциональные производные. Липиды.
Цель: Закрепить знания закономерностей и особенностей в химическом поведении карбоновых кислот и их функциональных производных, лежащих в основе важнейших биологических процессов; сформировать знания о строении и свойствах омыляемых липидов – структурных компонентов клеточных мембран; уметь проводить некоторые характерные и качественные реакции на кислоты.
Исходный уровень:
1. Электронное строение атома углерода (sp 3-, sp 2-гибридизация).
2. Цис - транс -изомерия.
3. Электронные эффекты заместителей.
4. Кислотность и основность. Водородные связи.
5. Механизм реакций электрофильного присоединения (АЕ) и нуклеофильного замещения (SN).
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Реакционная способность карбоновых кислот и их производных. Строение и свойства липидов».
2.1. Электронное строение карбоксилат-иона.
2.2. Функциональные производные карбоновых кислот – сложные эфиры, амиды и их гидролиз. Механизм реакции нуклеофильного замещения (SN).
2.3. Нейтральные липиды (триацилглицерины – ТАГ). Строение и стереоизомерия ненасыщенных высших жирных кислот.
2.4. Фосфолипиды. Фосфатидилколамины (кефалины) и фосфатидилхолины (лецитины) – структурные компоненты клеточных мембран.
2.5. Угольная кислота и ее производные.
3. Лабораторная работа по теме «Карбоновые кислоты».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Карбоновые кислоты и их функциональные производные необходимы для изучения многих последующих разделов биоорганической химии и таких дисциплин, как биохимия и фармакология.
Хлорангидриды и ангидриды кислот – ацилирующие агенты в химии белка; амиды – белки; сложные эфиры – липиды, выполняющие в организме двоякую биологическую роль – источника энергии и составной части клетки. Фосфолипиды участвуют в построении клеточных мембран.
Реакционная способность карбоновых кислот определяется электронным строением карбоксильной группы, которая одновременно содержит карбонильную и гидроксильную группы. p-Электроны OH-группы сопрягаются с p-электронами кратной связи группы >C=O (p,p-сопряжение). Это приводит к равномерному распределению электронной плотности между обоими атомами кислорода в карбоксильной группе и оказывает определяющее влияние на активность реакционных центров в ней.
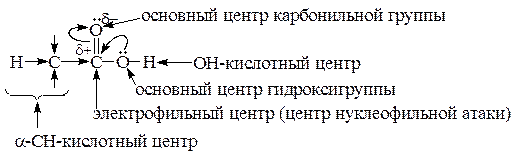
Вследствие p,p-сопряжения в карбоксильной группе:
1) уменьшается d+ на атоме углерода по сравнению с оксосоединениями, и для кислот не характерны реакции нуклеофильного присоединения, а только нуклеофильного замещения (SN), причем OH-группа легче уходящая, чем в спиртах;
2) усиливается основность оксониевого центра карбонильной группы (взаимодействие с H+-катализатором в реакциях SN);
3) увеличивается активность OH-кислотного центра по сравнению со спиртами (pKa(C2H5OH) = 18, а pKa(CH3COOH) = 5), и карбоновые кислоты взаимодействуют уже с оксидами, гидроксидами и солями активных металлов;
4) понижается активность основного центра гидроксигруппы в сравнении со спиртами.
Группа -СООН является сильным электроноакцептором (-I и –M), что приводит к усилению a-CH-кислотного центра и a-водородные атомы способны замещаться по радикальному механизму.
Вопросы для самостоятельной работы
«Карбоновые кислоты и липиды»
1. Напишите схему диссоциации уксусной кислоты. Приведите электронное строение карбоксилат-аниона и поясните более высокую активность OH-кислотного центра карбоновых кислот по сравнению со спиртами.
2. Расположите кислоты в ряд по увеличению кислотности:
а) муравьиную, хлоруксусную, фторуксусную, пропионовую, b-хлорпропионовую;
б) н -масляную, уксусную, хлоруксусную, щавелевую.
Результат поясните.
3. Напишите уравнения реакций солеобразования с гидроксидом кальция уксусной, щавелевой, пальмитиновой кислот.
4. Опишите механизм реакции этерификации:
а) уксусной кислоты и пропанола-2;
б) масляной кислоты и метилового спирта;
в) валериановой кислоты и этилового спирта;
Объясните необходимость кислотного катализа.
5. Напишите уравнение реакции получения полного и неполного амида малоновой кислоты. По какому механизму протекает эта реакция?
6. Покажите реакции образования ангидрида янтарной и уксусной кислот.
7. Напишите уравнение реакции декарбоксилирования:
а) щавелевой кислоты;
б) янтарной кислоты.
Объясните возможность протекания этой реакции.
8. Получите натриевую соль стеариновой кислоты из жира. Какое практическое применение имеют соли высших жирных кислот?
9. Напишите уравнение реакции гидрогенизации триацилглицерина, в состав которого входят олеиновая, линолевая и стеариновая кислоты.
10. Напишите схему взаимодействия пальмитоолеофосфатидной кислоты с коламином. К каким биологически активным соединениям относится конечный продукт? Его биороль.
11. Приведите структурную формулу фосфатидилхолина, в состав которого входят стеариновая и олеиновая кислоты, а также реакцию его кислотного гидролиза.
12. Напишите уравнение реакции образования и щелочного гидролиза кефалина, содержащего пальмитиновую и линолевую кислоты.
13. Напишите схему повреждения клеточных мембран при воздействии ионизирующего излучения.
14. Напишите уравнения реакций образования моно- и диамида угольной кислоты и биологически активные вещества на их основе: карбамоилфосфат, мепробамат, бромизовал. Укажите их биологическую активность.
15. Иминомочевина (гуанидин) и биологически активные вещества на ее основе: аргинин, гуанин и креатинфосфат, их биологическая роль.
Лабораторная работа по теме
«Карбоновые кислоты и их производные»
Опыт 1. Открытие уксусной кислоты
В пробирку поместите по 3 капли уксусной кислоты и воды. Испытайте реакцию раствора на лакмус. К раствору прибавьте 2-3 капли 10% раствора гидроксида натрия до полной нейтрализации уксусной кислоты. После этого добавьте 2-3 капли 1% раствора хлорида железа FeCl3. Появляется желто-красное окрашивание ацетата железа (III).
Нагрейте раствор до кипения. Выделяется красно-бурый осадок нерастворимого в воде гидроксида диацетата железа. Раствор над осадком становится бесцветным.
Вопросы:
1. Напишите схему диссоциации уксусной кислоты. Как подтверждается этот процесс экспериментально?
2. Напишите схему реакции уксусной кислоты с гидроксидом натрия. Как можно определить экспериментально нейтрализацию уксусной кислоты?
3. Напишите схему реакции образования ацетата железа (III).
4. Напишите структурную формулу гидроксида диацетата железа.
Опыт 2. Образование нерастворимых кальциевых солей
высших жирных кислот
В пробирку поместите 5 капель раствора мыла и добавьте 1 каплю раствора хлорида кальция CaCl2. Взболтайте содержимое пробирки. Появляется белый осадок.
Вопросы:
1. Напишите схему реакции образования кальциевой соли стеариновой кислоты.
2. Какие соединения называются мылами?
Опыт 3. Открытие щавелевой кислоты в виде кальциевой соли
В пробирку поместите лопаточку щавелевой кислоты и прибавьте 4-5 капель воды до полного растворения. Затем добавьте 1 каплю раствора хлорида кальция. Выпадает кристаллический осадок.
Вопросы:
1. Напишите схему реакции образования оксалата кальция.
Опыт 4. Получение этилацетата
В сухую пробирку поместите порошок безводного ацетата натрия (высота около 2 мм) и 3 капли этилового спирта. Добавьте 2 капли концентрированной серной кислоты и осторожно нагрейте над пламенем горелки (раствор может выплеснуться!). Через несколько секунд появляется приятный запах этилацетата.
Реакция используется для открытия этилового спирта.
Вопросы:
1. Напишите схему реакции образования этилацетата.
2. По какому механизму она осуществляется?
3. Какова роль концентрированной серной кислоты в реакции?
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1990; Нарушение авторских прав?; Мы поможем в написании вашей работы!