
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторно-практическое занятие № 5
|
|
|
|
Тема: Оксопроизводные (альдегиды и кетоны).
Цель: Изучить основные свойства оксосоединений, имеющих значение для биологических процессов. Уметь проводить качественные реакции на отдельные представители альдегидов и кетонов.
Исходный уровень:
1. Строение двойной связи.
2. Электронные эффекты заместителей.
3. Нуклеофильные и электрофильные реагенты.
4. Кислотность и основность органических соединений.
5. Реакции элиминирования (дегидратация).
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Биологически важные реакции карбонильных соединений».
2.1. Оксогруппа >С=О, ее электронное строение.
2.2. Реакции нуклеофильного присоединения (AN), механизм.
2.3. Реакции присоединения-отщепления.
2.4. Реакции альдольного присоединения и отщепления.
2.5. Реакции диспропорционирования.
2.6. Качественные реакции.
3. Лабораторная работа по теме «Оксосоединения».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Альдегиды и кетоны широко используются в медицине и промышленности. Формальдегид применяется в анатомической и гистологической практике, в производстве лекарственных средств (уротропин), пластмасс (фенолформальдегидные смолы). Уксусный альдегид применяется в производстве уксусной кислоты, этилацетата.
Хлоральгидрат – лекарственное средство седативного действия. Цитраль применяется в глазной практике. Карбонильная группа >C=O встречается во многих биологически важных соединениях.
Реакционная способность карбонильной группы связана с ее электронным строением:
альдегид кетон

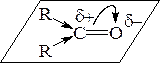
Реакционный центр – атом углерода карбонильной группы находится в состоянии sp 2-гибридизации и образует три s-связи, лежащие в одной плоскости под углом 120°, и p-связь за счет негибридизированной p -АО. Вследствие различия в электроотрицательности атомов углерода и кислорода p-связь >C=O сильно поляризована. В результате на атоме углерода карбонильной группы возникает эффективный положительный заряд d+, а на атоме кислорода – отрицательный заряд d-. Поскольку атом углерода электронно-дефицитен, то подвергается нуклеофильной атаке, которая заканчивается гетеролизом p-связи и образованием продуктов нуклеофильного присоединения (AN). Атака нуклеофилом может осуществляться как сверху, так и снизу плоскости.
Кетоны обладают меньшей реакционной способностью, так как электронные эффекты углеводородных радикалов уменьшают частичный положительный заряд на карбонильном атоме углерода и создают пространственные затруднения для нуклеофильной атаки.
В кислой среде активность карбонильной группы увеличивается, поскольку вследствие протонирования атома кислорода (центр электрофильной атаки) на атоме углерода возникает полный положительный заряд:
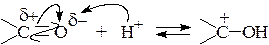
Кислотный катализ используют в тех случаях, когда атакующий нуклеофил обладает низкой активностью.
Вопросы для самостоятельной работы
«Оксосоединения»
1. Напишите уравнение реакции гидратации формальдегида, ацетальдегида и трихлоруксусного альдегида (хлораля). Какие из них дают устойчивые гидратные формы и почему? Каково медицинское значение хлоральгидрата?
2. Напишите уравнение реакции взаимодействия пропаналя с метиловым, этиловым или пропиловым спиртом. Опишите механизм, учитывая роль кислотного катализа и обратимость реакции.
3. Напишите уравнение реакции взаимодействия: а) ацетона; б) бензальдегида – с синильной кислотой (HCN) в щелочной среде.
4. Напишите уравнение реакции этаналя с: а) метиламином; б) аминобензолом (анилином). Укажите механизм реакции.
5. Напишите уравнение реакции получения гексаметилентетрамина (уротропина) и покажите его медицинское значение.
6. Напишите уравнение реакции альдольной конденсации ацетальдегида и пропаналя. Опишите механизм реакции. Будут ли вступать в эту реакцию триметилуксусный альдегид и бензальдегид? Какая структурная особенность альдегидов учитывается в этой реакции? Объясните причину появления CH-кислотного центра у альдегидов в реакции альдольной конденсации.
7. Напишите уравнение реакции диспропорционирования (реакция Канниццаро): а) формальдегида; б) бензальдегида. Какая особенность в строении предопределяет участие альдегида в этой реакции?
8. Напишите уравнение реакции восстановления: а) формальдегида; б) ацетальдегида; в) ацетона. Какое действие оказывают на организм эти вещества?
9. Напишите уравнение реакции окисления:
а) формальдегида оксидом серебра в водном растворе аммиака (реакция «серебряного зеркала»);
б) ацетальдегида гидроксидом меди (II).
Какие изменения в окраске происходят в ходе этих реакций? Будет ли в этих условиях окисляться ацетон?
10. Для открытия ацетона в моче больных сахарным диабетом используют йодоформную реакцию. Какие из соединений: диэтилкетон, метилэтилкетон, этанол, этаналь – также будут давать йодоформную пробу? Напишите химизм данной реакции.
Лабораторная работа по теме
«Оксосоединения»
Опыт 1. Диспропорционирование формальдегида
в водных растворах
Поместите в пробирку 2-3 капли 40% формалина. Добавьте 1 каплю 0,2% раствора индикатора метилового красного. Покраснение раствора указывает на кислую реакцию среды.
Вопросы:
1. Напишите реакцию диспропорционирования формальдегида. Наличие какого соединения обусловливает кислую реакцию среды?
Опыт 2. Окисление формальдегида и ацетона в щелочной среде
Окисление оксидом серебра (реакция серебряного зеркала).
Возьмите две пробирки и в каждую из них поместите по 1 капле 5% раствора нитрата серебра AgNO3 и 10% раствора гидроксида натрия NaOH. К полученному бурому осадку добавьте по каплям 10% водный раствор аммиака до полного его растворения. Затем в 1-ую пробирку прибавьте 2 капли 40% формалина, а во 2-ую – 2 капли ацетона. В 1-ой пробирке образуется осадок черного цвета, который при осторожном нагревании может выделиться на стенках пробирки в виде блестящего зеркального налета. Эта реакция носит название реакции «серебряного зеркала». Во 2-ой пробирке выпадение осадка не наблюдается.
Вопросы:
1. Напишите уравнение реакции «серебряного зеркала». Чем объясняется выпадение осадка черного цвета в 1-ой пробирке?
2. Что произойдет с продуктами реакции при дальнейшем окислении, то есть при избытке окислителя? Напишите уравнение реакции.
3. Объясните, почему во 2-ой пробирке не наблюдается выпадения осадка?
Окисление гидроксидом меди (реакция медного зеркала).
Поместите в каждую из двух пробирок по 5 капель 10% раствора гидроксида натрия и воды, добавьте по 1 капле 2% раствора сульфата меди CuSO4. К выпавшему осадку гидроксида меди (II) прибавьте в 1-ую пробирку 3 капли 40% раствора формалина, а во 2-ую – 3 капли ацетона. В 1-ой пробирке осадок приобретает сначала желтый цвет, затем – красный и, если пробирка чистая, на ее стенках может выделиться металлическая медь («медное зеркало).
Изменение окраски осадков объясняется различной степенью окисления меди.
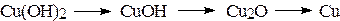
голубая желтая красная металлическая
окраска окраска окраска медь
Вопросы:
1. Наблюдается ли выпадение осадка во 2-ой пробирке?
2. Напишите реакцию окисления формальдегида гидроксидом меди (II).
3. Сравните способность к окислению формальдегида и ацетона на основании экспериментальных наблюдений.
Опыт 3. Открытие ацетона переводом его в йодоформ.
(используется для диагностики сахарного диабета)
В пробирку поместите 1 каплю раствора йода в иодиде калия и прибавьте почти до обесцвечивания по каплям 10% раствора гидроксида натрия. К обесцвеченному раствору добавьте 1 каплю ацетона. При слабом нагревании от тепла рук выпадает желто-белый осадок с характерным запахом йодоформа.
Вопросы:
1. Напишите реакцию образования йодоформа.
2. Способен ли этиловый спирт образовывать йодоформ?
3. Какие соединения можно обнаружить с помощью йодоформной пробы? Какие структурные фрагменты они должны содержать?
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1690; Нарушение авторских прав?; Мы поможем в написании вашей работы!