
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакционная способность гидроксисоединений
|
|
|
|
зависит от распределения электронной плотности в молекуле, вызванной введением группы -ОН:
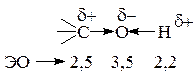
Углерод и водород, связанные с более электроотрицательным кислородом, становятся электронодефицитными и подвергаются нуклеофильной атаке. В зависимости от условий проведения реакции может произойти гетеролиз либо связи С-О (реакции нуклеофильного замещения – SN и элиминирования – Е), либо связи О-Н (проявление кислых свойств). Электроотрицательное влияние ОН-группы (-I) обуславливает подвижность a-водородных атомов в реакциях элиминирования (дегидратация, окисление по типу дегидрирования) Нуклеофильное замещение и элиминирование являются конкурирующими реакциями.
Вопросы для самостоятельной работы
«Гидроксисоединения»
1. Напишите по стадиям реакцию изопропилового спирта с HBr. По какому механизму она протекает?
2. Покажите реакцию н -пропилхлорида с водным раствором KOH. По какому механизму она протекает?
3. Напишите реакцию дегидратации в кислой среде (H2SO4):
а) этилового спирта; б) изопропилового спирта.
Укажите, по какому механизму она протекает.
4. Напишите схемы реакций окисления этанола и этантиола. В каком случае используются мягкие окисляющие реагенты?
5. Как относятся к окислению пропанол и 2-метилпропанол-2? Напишите схемы возможных реакций. Чем объясняется устойчивость третичных спиртов к окислению?
6. Напишите схему окислительно-восстановительной реакции взаимопревращения:
а) гидрохинон «хинон;
б) цистеин «цистин
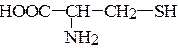 – цистеин (a-аминокислота)
– цистеин (a-аминокислота)
7. Покажите схему реакции, лежащей в основе действия:
а) 2,3-димеркаптопропанола;
б) унитиола
как антидотов при отравлении тиоловыми ядами.
8*. Объясните, почему метанол кипит при температуре значительно выше (т.кип. +64,7°С), чем этан (т.кип. -88,6°С), хотя их молекулярные массы близки.
Лабораторная работа по теме
«Гидроксисоединения»
Опыт 1. Получение этилата натрия и его гидролиз.
В сухую пробирку поместите 3 капли абсолютного (безводного) спирта и маленький кусочек металлического натрия, предварительно отжатый от керосина на фильтровальной бумаге. Закрыв пробирку пробкой, собрать выделяющийся водород. Затем пробку убрать и поднести пробирку отверстием к пламени спиртовки. Смесь водорода и воздуха горит с характерным «лающим» звуком. Белый осадок этилата натрия растворить в 2-4 каплях этанола, добавить 1 каплю 1% спиртового раствора фенолфталеина, 1-2 капли воды. Объясните появление малиновой окраски.
Уравнения: 1) C2H5OH + Na ®
2) гидролиз этилата натрия
Вопросы:
1. Почему спирты реагируют с натрием медленнее, чем вода?
2. Почему вода разлагает этилат натрия?
рКа(С2Н5ОН) = 18,0; рКа(Н2О) = 15,7.
Опыт 2. Получение этиленгликолята меди (II)
К 2 каплям 2% раствора сульфата меди (II) CuSO4 прибавить 2 капли 10% NaOH, получить хлопьевидный осадок гидроксида меди (II) Cu(OH)2. Добавить к нему 2 капли этиленгликоля, встряхнуть пробирку. Описать наблюдения и схему качественной реакции на диольный фрагмент.
Уравнения: 1) CuSO4 + NaOH ®
2) 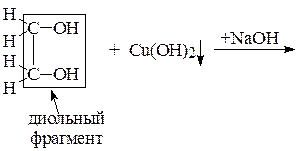
Опыт 3. Получение фенолята натрия и разложение его кислотой
В пробирку поместить 3 капли воды и несколько кристалликов фенола, встряхнуть. К образовавшейся мутной эмульсии добавить по каплям 10% раствор NaOH до растворения. Подкислить этот раствор несколькими каплями 10% раствора HCl.
Уравнения: 1) 
2) фенолят натрия + HCl ®
Вопросы:
1. Почему фенолят натрия не разлагается водой?
Опыт 4. Цветные реакции на фенолы
В три пробирки поместить по несколько кристалликов: в 1-ую – фенола; 2-ую – резорцина; 3-ю – пирокатехина. Добавить по 5-10 капель воды и 1-2 капли раствора хлорида железа (III). Описать окраску и схему взаимодействия фенола с FeCl3.
Опыт 5. Окисление этанола хромовой смесью
В пробирку поместить 2 капли этанола, 1 каплю 10% раствора H2SO4 и 2 капли 10% K2Cr2O7. Полученный оранжевый раствор нагреть на спиртовке до начала изменения окраски – появление сине-зеленой окраски сульфата хрома (III) Cr2(SO4)3. Продукт окисления этанола – уксусный альдегид – имеет характерный запах прелых антоновских яблок. Нюхать осторожно!
Уравнение: 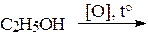
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1947; Нарушение авторских прав?; Мы поможем в написании вашей работы!