
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні закони та поняття стехіометрії
|
|
|
|
Загальні вимоги до оформлення контрольної роботи.
Контрольна робота повинна містить титульний лист, оформлений згідно з додатком Б.
Контрольна робота виконується в окремому зошиті або на окремих аркушах формату А4 з полями – (4 см) для зауважень рецензента.
Писати треба чітко та ясно.
Номери та умови завдань треба записувати у тому порядку, в якому вони стоять у завданні; відповіді повинні бути чіткими та вичерпними.
При виконанні розрахункового завдання необхідно провести розрахункові формули, обґрунтувати вибір відповідних коефіцієнтів.
Робота повинна мати дату надходження до кафедри та бути підписаною студентом.
При виконанні контрольної роботи не допускається скорочення тексту, крім загальновживаних.
У кінці роботи треба обов'язково вказати перелік використаної літератури згідно з встановленими вимогами.
В разі, якщо контрольна робота не зарахована, студент повинен виправити помилки та відповісти на зауваження рецензента і повторно повернути роботу відповідальному за реєстрацію.
Хімія – наука про речовини, їх структуру, властивості та взаємоперетворення.
Речовина – однорідний вид матерії, який при визначених умовах характеризується постійними фізичними та хімічними властивостями.
Структурна одиниця – найменша частинка речовини (молекула, атом, іон).
Атом – найменша, хімічна неподільна, електронейтральна частинка речовини, що складається з позитивно зарядженого ядра і негативно заряджених електронів
Молекула – найменша, фізично неподільна, електронейтральна частинка речовини, що має постійний склад і є носієм її хімічних властивостей.
Іон – електронодефіцитний або електрононадлишковий атом чи група атомів.
Атомна одиниця маси (а.о.м.) дорівнює 1/12 частині маси атому вуглецю – 12, тобто ізотопу вуглецю 12С.
Відносна атомна маса елемента показує, у скільки разів маса даного елемента більше 1/12 маси вуглецю 12С.
Відносна молекулярна маса речовини (Мr) – безрозмірна величина, що вказує у скільки разів маса однієї молекули певної речовини більша від атомної одиниці маси.
Хімічний елемент – тип атомів, що характеризуються певним протонним числом (кількість протонів у ядрі).
Речовини, які утворюються з атомів одного елемента називаються простими.
Речовини, що утворилися атомами різних елементів, називаються хімічними сполуками або складними речовинами.
Хімічна сполука – сукупність атомів (іонів), зв’язаних хімічними зв’язком, що характеризується індивідуальним набором фізичних і хімічних властивостей.
Моль – кількість речовини ν(X), що містить стільки структурних одиниць (молекул, атомів, іонів та інших), скільки атомів є в 0,0112 кг ізотопу Карбону 12С.
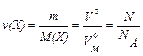
де m – маса речовини (наважка), г; V° – об’єм газу за нормальних умов (н.у.), л; N – число структурних одиниць речовини.
Число частинок – атомів, молекул у молі будь-якої речовини величина стала, вона дорівнює 6,022∙1023, її називають сталою Авогадро (позначається NА, має розмірність 1/моль).
Молярна маса – фізична величина, що дорівнює відношенню маси речовини до кількості речовини, яка їй відповідає. Її позначають літерою М(Х) з розмірністю кг/моль або г/моль.
Мольний об’єм (Vм) - об’єм, що займає 1 моль речовини при певних умовах. Для газів при нормальних умовах (н.у.) цей об’єм становить 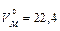 л.
л.
Масу одного атома чи однієї молекули в грамах m (Х) знаходять як частку від ділення молярної маси на сталу Авогадро:
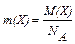 .
.
Нормальні умови (н.у.) – це умови, за яких температура становить 00С (273 К), а тиск – одну атмосферу (760 мм. рт. ст.; 101325 Па).
Валентність елемента (стехіометричне число) – число, що засвідчує властивість атомів даного елемента приєднувати або зміщувати певну кількість атомів інших елементів. За одиницю валентності взято один атом Гідрогену.
Хімічна формула – це скорочений запис хімічної речовини за допомогою хімічних знаків та індексів. Індекси в хімічних формулах вказують не тільки на число атомів у молекулі, але й число моль відповідних атомів в 1 моль речовини. Формули речовин, що складаються з двох елементів, визначають у відповідності з правилом: добуток валентності на число атомів одного елемента (сумарне число валентностей) дорівнює добутку валентності на число атомів другого елемента.
Формули розрізняють:
а) емпіричні – вказують на якісний та кількісний склад сполук;
б) структурні – відображають взаємозв’язок атомів у молекулі, допомагають визначити число хімічних зв’язків у атомів в сполуках молекулярної будови;
в) графічні (або формули валентності) – дозволяють визначити число валентних зв’язків у атомів при умовно-графічному зображенні сполук, але ніякої смислової інформації не несуть;
г) електронні – розкривають електронну будову як атомів.
Закон збереження маси речовини: «Сума мас речовин, що вступають у хімічну реакцію в ізольованій системі, дорівнює сумі мас речовин, що утворилися внаслідок реакції».
Закон збереження маси та енергії: «Сума маси речовин системи та маси, що еквівалентна енергії, отриманої чи відданої тією ж системою, постійна».
Закон сталості складу речовин: «Індивідуальні хімічні речовини мають сталий кількісний та якісний склад незалежно від умов та способу їх отримання».
Закон кратних відношень:«Різні масові кількості одного елемента, що припадають на однакову масову кількість іншого елемента у сполуках, утворених цими двома елементами, співвідносяться між собою як невеликі цілі числа».
Закон еквівалентів: «Речовини вступають у хімічну взаємодію у масових кількостях, пропорційних їх еквівалентним масам»:
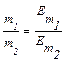
де m1 та m2 – маси реагуючих речовин; 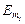 та
та 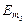 – молярні маси еквівалентів цих речовин.
– молярні маси еквівалентів цих речовин.
У випадку, коли одна з реагуючих речовин газоподібна, у формулі закону еквівалентів замість маси користуються її об’ємом (н.у.) та еквівалентний об’єм (ЕV):
 .
.
Для сполук, які реагують у розчині, закон еквівалентів можна записати наступним чином:
С1∙V1=С2V2,
де С1, С2 – молярні концентрації еквівалентів розчинів, моль-екв/л;
V1, V2 – об’єми реагуючих розчинів, мл.
Еквівалентом елемента або простої чи складної речовини називають таку їх кількість, яка приєднує або заміщує у хімічних реакціях один моль атомів Гідрогену, або взаємодіє з одним еквівалентом будь-якої речовини. Еквівалент позначається Е, одиницею виміру є моль.
Молярною масою еквіваленту елемента або речовини називають масу одного еквівалента. Її позначають Еm, одиниця виміру – г/моль.
Еквівалентну масу обчислюють за формулами:
простої речовини:
Е=1/В; Еm=М(Х)/В ЕV =Vм/В
складних сполук:
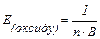
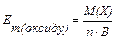 ,
,

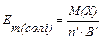 ,
,
де В, B’ – валентність елемента за Гідрогеном або катіону; n, n’ – число атомів елемента або кількість катіонів.
Еквівалент та молярна маса еквівалента основи або кислоти:
 ,
, 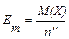
де n’’ – кислотність основи або основність кислоти.
Таким чином, для обчислення молярної маси еквівалента речовини в умовах хімічної реакції необхідно її молярну масу поділити на число еквівалентів речовини, з якою вона взаємодіє.
Основні газові закони:
Закон Авогадро – у рівних об’ємах при однаковій температурі і тиску утримується однакова кількість молекул.
Слідства закону Авогадро:
Ø моль будь-якого газу або газової суміші при однакових умовах займає однаковий об’єм;
Ø відношення мас однакових об’ємів різних газів, які знаходяться в однакових умовах, називають густиною одного газу за іншим.
Густину одного газу за іншим позначають DХ та обчисляють за формулою:
DХ2 = m1/m2 = М(Х1)/М(Х2)
Закон Бойля-Маріотта – за сталої температурі тиск, що приводиться даною масою газу, зворотно пропорційний об’єму газу (ізотермічний процес):
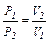 ; Р1·V1 = Р2·V2, або (Р·V)Т,ν = соnst
; Р1·V1 = Р2·V2, або (Р·V)Т,ν = соnst
Закон Шарля – відношення тиску до температури при сталому об’ємі для сталої кількості газу є величина постійна (ізохорний процес):
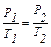 ; або (Р/Т)V,ν = соnst
; або (Р/Т)V,ν = соnst
Закон Гей-Люссака – відношення об’єму до температури при сталому тиску для сталої кількості газу є величина постійна (ізобарний процес):
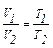 ; або (V/Т)Р,ν = соnst
; або (V/Т)Р,ν = соnst
Ідеальним називається газ, в якому можна знехтувати взаємодією між молекулами і прийняти їх за матеріальні точки.
Закон Клапейрона – добуток тиску на об’єм, поділений на абсолютну температуру, для постійної кількості газу є величина стала:
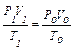 або
або 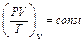 .
.
Закон (рівняння) Мендєлєєва – Клапейрона – добуток тиску газу на його об’єм пропорційний числу моль та абсолютній температурі:
рV = νRТ або 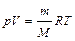
Якщо суміш газів, що не реагують між собою утворюють певний тиск, то вклад кожного із газів у загальний тиск називають парціальним тиском
Закон парціальних тисків – тиск газової суміші дорівнює сумі парціальних тисків її компонентів:
Рсум = Р1 + Р2 + … + Рi =Σ Рi
де Р1, Р2, Рi – парціальні тиски компонентів.
Закон Генри- Дальтона – парціальний тиск компонента газової суміші є пропорційним його мольній (об’ємній) частці і суміші:
Рi = Р·Хі,
де Р – сумарний тиск; Хі – мольна (об’ємна) частка компонента.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 837; Нарушение авторских прав?; Мы поможем в написании вашей работы!