
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язання типових задач
|
|
|
|
Приклад 1. Обчислити значення масових часток елементів в нітритній кислоті.
Рішення:
Розрахуємо значення Мr кислоти:
Мr (HNO2) = Аr (H) + Аr (N) + 2 Аr (O) = 1 + 14 + 32 = 43
Розрахуємо значення масової частки елементів
 або 2,1%
або 2,1%
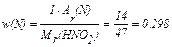 або 29,8%
або 29,8%
 або 68,1%
або 68,1%
Приклад 2. Визначити формулу одного з оксидів нітрогену, у якому масова частка кисню складає 63,15%.
Рішення:
Приймаємо, що маса оксиду NxOy дорівнює 100 г. Розрахуємо маси атомів нітрогену та кисню у оксиді:
m (O) = m (NxOy) · w (O) = 100 · 63,15: 100 = 63,15 г;
m (N) = m (NxOy) – m (O) = 100 – 63,15 = 36,85 г.
Визначимо кількість атомів нітрогену та кисню:
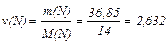 моль;
моль;
 моль.
моль.
Знаходимо молярне співвідношення нітрогену та кисню у оксиді:
ν (N): ν (O) =2,632: 3,947 = 2: 3.
Відповідно, формула оксиду – N2O3.
Приклад 3. Невідома речовина масою 6 г спалили в надлишку кисню й одержали вуглекислий газ масою 8,8 г і воду масою 3,6 г. Визначити молекулярну формулу згорілої речовини, якщо відносна густина його пари за повітрям дорівнює 3,103.
Рішення:
Оскільки при згоранні речовини утворюється вуглекислий газ і вода, робимо висновок, що в його сполуку входять карбон, гідроген і, можливо, кисень.
1) Розрахуємо масу карбону у СО2 що утворилось:
М(СО2) = 12 + 2·16 = 44 г/моль;
44 г (СО2) містять 12 г (С)
8,8 г (СО2) -"- х г (С); х = 2,4г (С).
2) Розрахуємо масу гідрогену у воді, що утворилася:
М(Н2О) =1·2 + 16 = 18 г/моль;
18 г (Н2О) містять 2 г (Н)
3,6 г (Н2О) -"- у г (Н); у = 0,4 г (Н).
3) Знайдемо суму мас вуглецю й гідрогену, що входили до складу вихідної речовини:
m(С) + m(Н) = 2,4 + 0,4 = 2,8 г
4) Оскільки сума мас С и Н (2,8 г) менше маси згорілої речовини (6 г), робимо висновок, що сполука містить також і кисень, маса якого дорівнює m(О) = 6 – 2,8 = 3,2 г.
5) Визначимо найпростіше молярне співвідношення С, Н и О у вихідній речовині, тобто його найпростішу формулу:
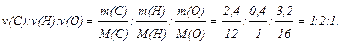
Таким чином, найпростіша (емпірична) формула речовини СН2О.
Слід зазначити, що найпростіша формула речовини відображає лише найпростіше (найменше) числове співвідношення атомів елементів у ньому. Молекулярна ж формула речовини відбиває реальне число атомів кожного елемента в молекулі й виходить множенням індексів у найпростішій формулі на певне число раз.
6) Розрахуємо значення молярної маси вихідної речовини по його відносній густині:
М1 (СxНyОz) = 29 · D(пов) = 29 · 3,103 = 90 г/моль
7) Розрахуємо значення молярної маси вихідної речовини по його найпростішій формулі:
М2 (СН2О) = 12 + 2 · 1 + 16 = 30 г/моль
8) Оскільки значення М1 більше значення М2 в 3 рази, то для знаходження молекулярної формули речовини всі індекси в його найпростішій формулі потрібно збільшити в 3 рази. Таким чином, шукана формула – С3Н6О3.
Приклад 4. Визначити число еквівалентності, фактор еквівалентності, еквівалент і молярну масу еквівалента фосфорної кислоти в реакції:
Са(ОН)2 + Н3РО4 → СаНРО4 + 2Н2О.
Рішення:
1) Знаходимо число еквівалентності n. У даній реакції від однієї молекули Н3РО4 2 іони Н+ можуть від’єднатися або, інакше кажучи, одній молекулі кислоти еквівалентні (хімічно відповідають) 2 іони Н+. Тому число еквівалентності n у даній реакції дорівнює 2.
2) Знаходимо фактор еквівалентності й визначаємо еквівалент кислоти:
 .
.
Це значить, що одному іону Н+ у даній реакції відповідає 1/2 частина (половина) молекули кислоти, що і є в даній реакції її хімічним еквівалентом.
3) Знаходимо молярну масу еквівалента кислоти:
 , г/моль
, г/моль
Приклад 5. Визначити еквівалент і розрахувати молярну масу еквівалента хрому (III) гідроксиду у реакції:
2Сr(ОН)3 + 3Н2SO4 = Сr2(SO4)3 + 6Н2O.
Рішення:
1) Знаходимо число еквівалентності Сr(ОН)3:
2 часткам Сr(ОН)3 відповідають 6 іонів Н+,
1 частці -" - х іонів,
звідки х = 3. Виходить, число еквівалентності хром (ІІІ) гідроксиду n у даній реакції дорівнює 3.
2) Знаходимо фактор еквівалентності Сr(ОН)3 і обумовлений його хімічний еквівалент:
3 іонам Н+ еквівалентна 1 частка Сr(ОН)3,
1 іону Н+ -" - у часток, звідки у = 1/3.
Це значить, що в даній реакції еквівалентом хром (III) гідроксиду є умовна частка – 1/3 частина його формульної одиниці.
3) Розрахуємо значення молярної маси еквівалента Сr(ОН)3:
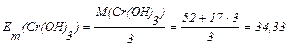 , г/моль
, г/моль
Приклад 6. Визначити еквівалент і розрахувати молярну масу еквівалента манган (II) гідроксиду у реакції:
2Мn(ОН)2 + 12КОН + 5Сl2 → 2КМnО4 + 10КСl + 8Н2O.
Рішення:
1) Знаходимо число еквівалентності для Мn(ОН)2:
Оскільки у формульній одиниці цього гідроксиду містить атом мангану в ступені окиснення +2, а у формульній одиниці КМnО4 – у ступені окиснені +7, робимо висновок, що 1 частці Мn(ОН)2 відповідають 5 електронів. Виходить, число еквівалентності гідроксиду дорівнює 5.
2) Знаходимо фактор еквівалентності гідроксиду й визначаємо його хімічний еквівалент:

Це значить, що в даній реакції еквівалентом манган (II) гідроксиду є умовна частка – 1/5 частина його формульної одиниці.
3) Розрахуємо значення молярної маси еквівалента гідроксиду:
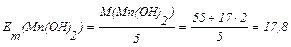 г/моль
г/моль
Приклад 7. Визначити еквівалент і розрахувати значення молярної маси еквівалента алюміній сульфату в реакції:
Аl2(SO4)3 + 3Рb(NO3)2 = 2Аl(NO3)3 + 3РbSО4.
Рішення:
1) Знаходимо число еквівалентності Аl2(SO4)3.
У даній реакції обміну не приймають участі іони Н+. У цьому випадку приймаються в увагу інші іони з постійним зарядом, рівним +1 або – 1. У нашім прикладі це іони NO3–. З рівняння реакції видно, що одній частці Аl2(SO4)3 еквівалентні 6 іонів NO3–, тобто число еквівалентності n для алюмінію сульфату дорівнює 6.
2) Знаходимо фактор еквівалентності й визначаємо еквівалент:
6 іонам NO3– відповідає 1 частка Аl2(SO4)3,
1 іону -" - х часток, звідки х = 1/6.
Це значить, що в даній реакції обміну хімічним еквівалентом алюміній сульфату є умовна частка – 1/6 частина його формульної одиниці.
3) Розрахуємо значення молярної маси еквівалента:
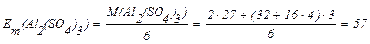 г/моль.
г/моль.
Приклад 8. Визначити еквівалент і розрахувати значення молярного об'єму еквівалента сірководню в реакції:
Н2S-2 + 8 HNO3 → Н2S+6O4+ 8NO2 + 4Н2O.
Рішення:
1) Знаходимо число еквівалентності Н2S. Оскільки в молекулі сірководню ступінь окиснення сірки дорівнює – 2, а в молекулі сульфатної кислоти вона дорівнює +6, робимо висновок, що 1 молекулі Н2S відповідають 8 електронів. Це значить, що число еквівалентності сірководню в даній реакції дорівнює 8.
2) Знаходимо фактор еквівалентності сірководню й визначаємо його еквівалент:
8 електронам відповідає 1 молекула Н2S,
1 електрону -" - х молекул, звідки х = 1/8.
Це значить, що хімічним еквівалентом сірководню в даній реакції є умовна частка - восьма частина його молекули.
3) Знаходимо значення молярного об'єму еквівалента сірководню:
 л/моль.
л/моль.
Приклад 9. Невідомий метал масою 10,0 г спалили в кисні й одержали оксид металу масою 18,89 г. Визначити метал.
Рішення:
Запишемо загальну схему реакції: Ме° + О2 → Ме2+хО-2.
Відповідно з законам еквівалентів хімічна кількість еквівалента металу дорівнює хімічній кількості еквівалента кисню:
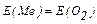 , звідси
, звідси 
1) Знайдемо масу кисню, що вступив у реакцію:
m(O2) = m(оксиду) – m(металу) = 18,89 – 10,0 = 8,89 г.
2) Знайдемо молярну масу еквівалента молекулярного кисню. При утворенні оксиду кожна молекула кисню приєднує 4 електрони й перетворюється в 2 оксид-іона:  . Тоді:
. Тоді:
4 електронам відповідає 1 молекула O2,
1 електрону -" - х молекул, звідки х = 1/4.
Це значить, що хімічним еквівалентом кисню в даній реакції є умовна частка – четверта частина молекули. Знайдемо значення молярної маси еквівалента кисню:
 г/моль
г/моль
3) Підставимо числові значення величин у вираження закону еквівалентів:
 г/моль
г/моль
4) Для металу число еквівалентності n дорівнює ступеня його окислювання в сполуці. Оскільки М(Ме) = Em(Ме)·n, відповідно при
n = 1 М(Ме) = 9 г/моль;
n = 2 М(Ме) = 18 г/моль;
n = 3 М(Ме) = 27 г/моль.
Одновалентного металу з молярною масою 9 г/моль і двовалентний метал з молярною масою 18 г/моль не існує. Тривалентний метал з молярною масою 27 – алюміній (Аl).
Приклад 10. При розчиненні в кислоті металу масою 9,58 г виділився водень об'ємом 6,72 л (н.у.). Визначити метал.
Рішення:
Запишемо загальну схему реакції: Ме° + nН+ → Меn+ + n/2 Н2.
Відповідно до закону еквівалентів, кількість речовини еквівалента металу дорівнює кількості речовини еквівалента гідрогену. Отже,
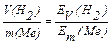
1) Розрахуємо значення молярного об'єму еквівалента гідрогену. Оскільки молекула гідрогену утвориться за схемою: 2Н+ +2ē → Н2, то:
2 електронам відповідає 1 молекула Н2,
1 електрону відповідає х молекул, звідки х = 1/2
Таким чином, еквівалентом гідрогену в даній реакції є умовна частка – половина його молекули. Тому молярний об'єм еквівалента гідрогену дорівнює:
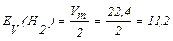 л/моль
л/моль
2) Підставимо значення величин у рівняння закону еквівалентів, знайдемо молярну масу еквівалента металу й визначимо метал.
 г/моль
г/моль
Оскільки М(Ме) = Em(Ме)·n, відповідно при
n = 1 М(Ме) = 15,97 г/моль;
n = 2 М(Ме) = 31,94 г/моль;
n = 3 М(Ме) = 47,9 г/моль.
Одно- і двовалентного металів зі знайденими значеннями молярних мас не існує. Тривалентний метал з молярною масою 47,9 – титан (Ti).
Приклад 11. Із хлориду невідомого металу масою 18,34 г отриманий нітрат цього ж металу масою 23,64 г. Визначити метал.
Рішення:
1) Оскільки хімічна кількість еквівалента хлориду металу дорівнює хімічній кількості еквівалента його нітрату, то:

При рішенні подібних завдань необхідно пам'ятати, що молярна маса еквівалента складної речовини дорівнює сумі молярних мас еквівалентів його складових частин. Допустимо, що молярна маса еквівалента невідомого металу дорівнює х г/моль. З огляду на, те що молярна маса еквівалента хлорид-аніона Сl – = 35,5 г/моль, а молярна маса еквівалента нітрат-аніона NO –3 дорівнює 62 г/моль і підставивши значення величин у рівняння закону еквівалентів, одержимо:
 , звідси х = 56,2 г/моль.
, звідси х = 56,2 г/моль.
2) Визначимо метал.
Оскільки М(Ме) = Em(Ме)·n,
де n –ступінь окислювання металу в сполуці, то при n=1, М(Ме) =56,2 г/моль – метал не існує; при n = 2, М(Ме) = 56,2 · 2 = 112,4 г/моль – метал кадмій (Сd).
Приклад 12. При тиску 98,5 кПа об'єм газу дорівнює 10,4 л. Обчислити значення об'єму газу при тиску 162,6 кПа.
Рішення:
З рівняння Бойля-Маріота виразимо V2 і знайдемо його значення:
 л
л
Приклад 13. При температурі 18 °С об'єм газу дорівнює 6,72 л. Обчислити значення об'єму даного газу при температурі 118 °С.
Рішення:
1) Розрахуємо абсолютні значення температури:
а) T1 = t1 + 273 = 18 + 273 = 291 К;
б) Т2 = t2 + 273 = 118 + 273 = 391 К.
2) З рівняння Гей-Люсака виразимо V2 і розрахуємо його значення:
 л
л
Приклад 14. При температурі 45 °С и тиску 68,8 кПа об'єм газу дорівнює 120,4 л. Обчислити значення об'єму газу при нормальних умовах.
Рішення:
З рівняння об'єднаного газового закону виразимо V0 і розрахуємо його значення:
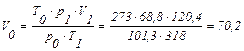 л
л
Приклад 15. Обчислити значення молярної маси речовини, якщо його пари масою 2,6 г при температурі 87 °С и тиску 83,2 кПа займають об'єм, рівний 1200 мл.
Рішення:
З рівняння Клапейрона-Менделєєва виразимо М і розрахуємо її значення:
 г/моль
г/моль
Приклад 16. Загальний тиск суміші, що складає з азоту масою 14 г і кисню масою 8 г, дорівнює 155 кПа. Обчислити значення парціальних тисків газів у суміші.
Рішення:
Оскільки в суміші об'ємні частки газів чисельно рівні їхнім мольним часткам, то в цьому випадку парціальні тиски газів будуть пропорційні їхнім мольним часткам.
1) Розрахуємо хімічну кількість кожного з газів:
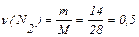 моль;
моль;
 моль;
моль;
2) Розрахуємо значення молярних часток газів у суміші:
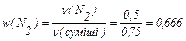
Отже, молярна частка кисню w(O2) дорівнює:
w(O2) = 1 – 0,666 = 0,334.
3) Розрахуємо значення парціальних тисків газів:
p(N2) = w(N2) · Р(суміші) = 0,666 · 155 = 103,23 кПа;
p(О2) = w(O2) · Р(суміші) = 0,334 · 155 = 51,77 кПа.
Приклад 17. У посудині об'ємом 6 л змішали кисень об'ємом 3,5 л, що перебував під тиском 125 кПа, і азот об'ємом 5,5 л, що перебував під тиском 105 кПа. Обчислити парціальні тиски газів і загальний тиск отриманої суміші.
Рішення:
1) По рівнянню Бойля-Маріота розрахуємо нові тиски газів після їхнього змішування (тобто парціальні тиски):
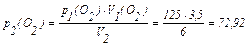 кПа;
кПа;
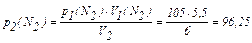 кПа.
кПа.
2) Знайдемо загальний тиск суміші:
Р(суміші) = р(1) + р(2) = 72,92 + 96,25 = 169,17 кПа.
Приклад 18. У балоні об'ємом 44,5 л при температурі 19 °С утримуються кисень масою 27,2 г, вуглекислий газ масою 55,0 г і азот невідомої маси. Обчислити значення маси азоту в суміші, якщо її тиск дорівнює 139,05 кПа.
Рішення:
1) З рівняння Клапейрона - Менделєєва виразимо тиск і розрахуємо його значення для кисню й вуглекислого газу:
 ;
;
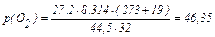 кПа;
кПа;
 кПа.
кПа.
2) Розрахуємо парціальний тиск азоту в суміші:
р(N2) = Р (суміші) – р(СО2) – р(О2) = 139,05 – 68,16 – 46,35 = 24,5 кПа.
3) Розрахуємо значення маси азоту в суміші:
 г.
г.
Приклад 19. У газометрі над водою при температурі 25 °С утримується кисень об'ємом 5,2 л під тиском 102,455 кПа. Розрахувати значення об'єму сухого кисню в газометрі при н.у., якщо тиск насиченої водяної пари при 25 °С дорівнює 3,164 кПа.
Рішення:
1) Розрахуємо значення парціального тиску чистого кисню в суміші:
р(О2) = Р(суміші) – р(Н2О) = 102,455 – 3,164 = 99,291 кПа.
2) З рівняння об'єднаного газового закону виразимо V0 і розрахуємо його значення:
 л.
л.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 12831; Нарушение авторских прав?; Мы поможем в написании вашей работы!