
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 2
|
|
|
|
Изобразите структурные формулы всех альдегидов молекулярной формулы С5Н10О и назовите их по номенклатуре IUPAС.Какое из этих соединений может иметь оптические изомеры*? Изобразите их. По каким свойствам и как отличаются оптические изомеры?
Решение.
Альдегиды – класс органических соединений общей формулы СnН2nО, содержащих альдегидную группу - СНО. Как видно, один атом С входит в состав альдегидной группы, тогда в алкильном радикале, связанном с этой группой, остается 4 атома углерода. Вспоминаем все алкильные радикалы с формулой -С4Н9 (их четыре), соединяем с группой –СНО и получаем четыре формулы альдегидов:
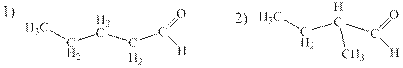
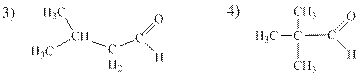
Для построения названия по номенклатуре IUPAC выбираем главную углеродную цепь, содержащую альдегидную группу. При этом атому углерода альдегидной группы всегда приписывают № 1, который в названии опускается. Называем заместители (указывая номер атома С), главную углеродную цепь, в конце названия добавляем суффикс –аль. Итак, 1) пентаналь, 2) 2-метилбутаналь, 3) 3-метилбутаналь и 4) 2,2-диметил-пропаналь (если нет никаких других вариантов изображения структуры, то цифры в названии можно опускать, тогда это - диметилпропаналь).
Для ответа на второй вопрос надо вспомнить, что такое «оптическая изомерия».
*Оптическая изомерия – вид пространственной изомерии, выражается в способности молекулы существовать в виде двух «зеркальных» изомеров. Необходимым (но не достаточным) условием существования оптических изомеров является наличие в молекуле асимметрического (или хирального) атома С, который связан с четырьмя разными заместителями. Оптические изомеры отличаются только разным расположением этих заместителей и являются «зеркальным отражением» друг друга. Среди всех изображенных изомерных альдегидов только в молекуле 2-метилбутаналя атом С2 является асимметрическим (Н в данном случае тоже рассматривается как заместитель).
Оптические изомеры проявляют одинаковые химические и физические свойства, пока их окружение не является оптически активным (например, неспособно существовать в виде оптических изомеров). Так, растворимости оптических изомеров в воде (оптически неактивное окружение) не отличаются друг от друга. Напротив, растворы разных оптических изомеров вращают плоскость поляризованного света (оптически активное окружение) в разные стороны.
Взаимосвязь строения карбонильных соединений и их свойств
Строение карбонильной группы. Наличие двойной связи между атомами углерода и кислорода позволяет предсказать, что карбонильные соединения способны к реакциям присоединения.
В отличие от алкенов, карбонильная группа полярна: атом кислорода, как более электроотрицательный, стягивает электронную плотность как по σ -связи [(-I) – отрицательный индуктивный эффект], так и по π -связи [(-M) – отрицательный мезомерный эффект]. Следовательно, на атоме углерода карбонильной группы возникает частичный положительный заряд (δ+), а на атоме кислорода – частичный отрицательный заряд (δ-). Поскольку атом кислорода проявляет одновременно два эффекта, (-I) и (-M), то частичные заряды (δ-) на атоме кислорода и (δ+) на атоме углерода гораздо больше, чем в спиртах.
Вывод: атом углерода карбонильной группы активирован для атаки нуклеофильными реагентами, которые вступают с карбонильными соединениями в реакции нуклеофильного присоединения.
Влияние карбонильной группы на соседний атом углерода. Оказывается, атом водорода в соседнем положении к карбонильной группе обладает высокой подвижностью. Карбонильные соединения подобны хамелеону: большую часть времени двойная связь находится в составе карбонильной группы, но в некоторый момент перемещается в соседнее положение. При этом образуется енол или енольная форма. Такое название возникло благодаря суффиксам, которые используют для названия алкенов (ен) и спиртов (ол). А явление миграции двойной связи получило название кето-енольная таутомерия. Таутомерией называется явление, когда вещество способно существовать в нескольких (обычно двух) формах, которые находятся в равновесии между собой.
Внимание: существует принципиальная(!) разница между таутомерным превращением и резонансными структурами. Резонансные структуры отвечают разному распределению электронной плотности в одном и том же соединении, при этом все атомы остаются на месте. В ходе таутомерного превращения наблюдается равновесие между двумя соединениями, которое происходит благодаря перемещению атомов и связей.
Окисление альдегидов. Связь карбонильного атома углерода с атомом водорода легко подвергается окислению даже кислородом воздуха. При этом альдегидная группа превращается в карбоксильную, а сам альдегид – в карбоновую кислоту.
Химические свойства
Пример 3. Расположите в порядке возрастания реакционной способности в реакциях нуклеофильного присоединения следующие карбонильные соединения: бутаналь, пропанон, метилбутанон и 2-хлорпропаналь. Объясните своё решение с помощью электронных эффектов заместителей.
Решение.
1) Сначала рассмотрим электронное строение карбонильной группы и распределение в ней электронной плотности. Изобразим структурную формулу этой группы и определим типы связей в ней:
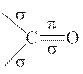
Атомы С и О этой группы находятся в sp2 –гибридном состоянии:
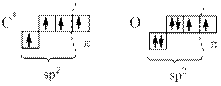
При построении карбонильной группы «методом перекрывания электронных облаков» изображаем только те электронные орбитали, которые участвуют в образовании ковалентных σ‑ и π-связей:
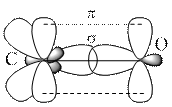
Поскольку атом О более электроотрицательный, чем атом С, электроны ковалентных связей смещены в сторону атома О. Смещение электронов σ–связи называется индуктивным эффектом смещения электронной плотности (обозначается латинской буквой I), а π–связи – мезомерным эффектом (обозначается буквой M). При этом считается, что атом С проявляет положительный индуктивный (+I) и положительный мезомерный (+M) эффекты, а атом O – отрицательный индуктивный (-I) и отрицательный мезомерный (-M) эффекты. В результате такого смещения электронов на атоме О появляется избыток электронной плотности (что обозначается значком «δ˗», читается: «дельта-минус»), а на атоме С – дефицит (что обозначается значком «δ+», а читается: «дельта-плюс»), т.е. карбонильная группа становится полярной.
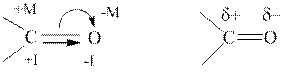
2) Далее обращаемся к понятию «нуклеофильное присоединение». Такое название обозначает, что определяющей стадией процесса является атака нуклеофильной частицы Nu˗ по электронодефицитному атому углерода. Значит, чем больше значение «δ+» на атоме С, тем активнее эта группа будет взаимодействовать с нуклеофилом, т.е. выше её реакционная способность. И наша задача сводится, по сути, к определению и сравнению величины «δ+» на атоме углерода карбонильной группы каждой молекулы.
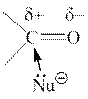
За точку отсчета возьмем бутаналь. В этой молекуле имеется одна алкильная группа ‑СН2‑СН2-СН3 (пропильная), которая, обладая (+I)-эффектом, частично компенсирует положительный заряд на атоме С; его величину обозначим: (δ+)1.
В пропаноне есть две алкильные СН3-группы, поэтому компенсация положительного заряда на атоме С значительнее, обозначим его (δ+)2.
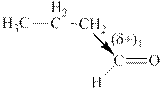
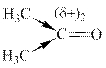
Очевидно, что (δ+)1 > (δ+)2, т.е. при взаимодействии с нуклеофилом реакционная способность бутаналя выше, чем пропанона.
3) Молекула метилбутанона, в сравнении с пропаноном, содержит одну метильную и одну изопропильную группу, которая обладает более сильным +I-эффектом, чем метильная. Тогда (δ+)3 < (δ+)2, т.е. метилбутанон менее активен в реакции с нуклеофилом, чем пропанон.
4) В молекуле 2-хлорпропаналя электроноотрицательный атом Cl проявляет -I-эффект, следовательно, увеличивает положительный заряд на атоме С – (δ+)4, который будет наибольшим среди всех рассмотренных молекул: (δ+)3 < (δ+)2 < (δ+)1 < (δ+)4.
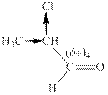
Следовательно, ряд этих соединений в порядке возрастания их реакционной способности будет выглядеть так:
метилбутанон < пропанон < бутаналь < 2-хлорпропаналь.
Пример 4. Предложите схему синтеза циклогексанона из неорганических реагентов.
Решение.
Назовите все органические вещества.

Решение.
Две стрелки слева направлены к бутаналю, т.е. в этих реакциях бутаналь является продуктом реакции, и требуется предложить два способа его получения.
1) Один из способов получения альдегидов (и кетонов тоже) – это щелочной гидролиз: действие водного раствора щелочи (КОН/Н2О) на гем- дигалоидалканы. В этих условиях происходит нуклеофильное замещения атомов галогена на гидроксогруппы. Однако, при гем- расположении (у одного атома углерода) двух гидроксогрупп получается неустойчивое соединение: элиминирование из него молекулы воды приводит к устойчивому карбонильному соединению. Тогда уравнение реакции получения бутаналя этим способом:

2) Другим способом получения альдегидов является мягкое окисление спиртов, например, оксидом меди (II). При этом альдегиды получаются из первичных спиртов, и реакцию получения бутаналя можно написать так:
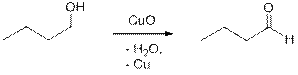
Способы получения
Методов синтеза карбонильных соединений существует много. Поэтому при синтезе соединения заданной структуры, как правило, требуется анализ, какой из методов лучше подходит для достижения цели.
Наиболее общими методами синтеза альдегидов и кетонов являются реакции окисления первичных и вторичных спиртов соответственно. Поскольку альдегиды чувствительны к дальнейшему окислению, не всякий реагент нам подойдет.
Известным Вам простым и эффективным способом получения уксусного альдегида и кетонов является гидратация ацетилена и алкинов соответственно (реакция Кучерова). Другие альдегиды получить не удается, так как реакция происходит по правилу Марковникова.
Пожалуй, самое значительное место занимают реакции конденсации карбонильных соединений и эфиров карбоновых кислот, которые также приводят к получению карбонильных соединений (альдольно-кротоновая, бензоиновая, Кляйзена, Дикмана и др.). Такие реакции являются довольно сложными и в школьном курсе органической химии не рассматриваются.
На практике довольно редко применяют гидролиз гем-дигалогеналканов раствором щелочи. Невысокая популярность такого подхода обусловлена, во-первых, низкой доступностью дигалогеналканов[16], во-вторых, побочными превращениями карбонильных соединений в щелочной среде (например, альдольно-кротоновой конденсация).
Одним из промышленных методов получения кетонов является пиролиз солей карбоновых кислот. Данный метод, по существу, органичен получением только кетонов симметричного строения (т.е. оба радикала одинаковые). С другой стороны, таким способом целесообразно получать циклические кетоны, например, циклопентанон из кальциевой соли адипиновой кислоты.
Удобным способом синтеза ароматических кетонов является реакция ацилирования аренов по Фриделю-Крафтсу.
Особое место для получения карбонильных соединений занимает применение металлорганических соединений, в том числе, реактивов Гриньяра. Для того, чтобы исключить дальнейшие превращения карбонильной группы под действием реактива Гриньяра, в реакционную массу добавляют соли кадмия. Происходит переметаллирование, а кадмийорганические соединения намного менее активны, чем магнийорганические. Важность данного метода связана не столько с его распространением, сколько с его использованием для получения некоторых труднодоступных карбонильных соединений.
Пример 5. Предложите схему синтеза циклогексанона из неорганических реагентов.
Решение.
При решении синтетической задачи, в общем случае, есть две проблемы: сборка углеродного скелета молекулы и создание функциональных групп.
В данной задаче нам предстоит собрать шестичленный цикл и создать карбонильную группу. Поскольку нам неизвестны превращения кетонов, которые приводили бы к модификации углеродного скелета молекулы, логика решения должна быть такой: сначала собрать углеродный скелет, затем на его основе создать карбонильную группу.
Задачу решаем «с конца»: циклогексанон можно получить окислением циклогексанола или щелочным гидролизом дихлор- или дибромциклогексана. Удобного способа получения 1,1‑дигалогенциклогексана у нас нет (радикальное галогенирование циклогексана приведет к единственному моногалогенциклогексану и, затем, к сложной неразделимой смеси изомерных дигалогенциклогексанов).
Значит, единственный возможный путь состоит в получении целевого продукта окислением циклогексанола. Для синтеза циклогексанола возможны два подхода: во-первых, нуклеофильное замещение атома галогена в галогенциклогексане реакцией с гидроксидом щелочного металла в водном растворе. Галогенциклогексан получают реакцией галогенирования циклогексана. Во-вторых, можно использовать реакцию гидрирования фенола (гидроксильная группа восстанавливается с большим трудом).
Таким образом, задача сводится к получению либо циклогексана, либо фенола
Как получить циклогексан? Поскольку способов построения шестичленного цикла Вам неизвестно, необходимо «обойти» проблему. Какие соединения с шестичленным циклом Вы умеете получать? Разумеется, бензол. А бензол можно превратить в циклогексан реакцией гидрирования.
Способы получения фенола были приведены в предыдущей главе (см.).
В результате можно предложить следующую схему:
ВСТАВИТЬ СХЕМУ
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2369; Нарушение авторских прав?; Мы поможем в написании вашей работы!