
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 6
|
|
|
|
Пример 5.
Получите бутанон-2 из пропанола-1.
Решение.
Сложность постановки данной задачи состоит в том, что надо спланировать такой синтез, который не только приводит к целевому соединению, но и использует в качестве исходного именно пропанол-1.
Смесь 2-метилпропанола-1, бутанола-2 и 2-метилпропанола-2 массой 2.7 г окислили оксидом меди (II). Продукты окисления обработали аммиачным раствором оксида серебра, при этом образовалось 5.4 г металлического серебра. Вычислите массовую долю 2-метилпропанола-1 в исходной смеси.
Решение.
По названиям определяем, что исходные соединения – предельные одноатомные спирты. Изобразим их структурные формулы:
Видно, что 2-метилпропанол-2 – третичный спирт, а значит, он не окисляется оксидом меди. 2-Метилпропанол-1 – первичный спирт, при таком окислении превращается в альдегид (2-метилпропаналь):
Бутанол-2 является вторичным спиртом, поэтому оксидом меди окисляется до кетона (бутанон-2):
Так что продуктами окисления оксидом меди исходной смеси являются 2-метил-пропаналь (альдегид) и бутанон-2 (кетон).
Известно, что аммиачный раствор оксида серебра взаимодействует с альдегидами, окисляя их до карбоновых кислот. (В этой реакции выделяется металлическое серебро (Ag), покрывающее стенки сосуда зеркальной плёнкой, за что реакция получила название «серебряного зеркала» и является качественной на альдегиды). Кетон же аммиачным раствором оксида серебра не окисляется. Напишем уравнение реакции для 2-метил-пропаналя, молекулярная формула которого С4Н8О:
По условию задачи в этой реакции получено 5.4 г серебра, что составляет:
ν(Ag) = m(Ag)/M(Ag) = 5.4г/108 г/моль = 0.05 моль
По уравнению количество альдегида – в два раза меньше, что составляет:
ν(альдегида) = ν(Ag) / 2 = 0.025моль. М (альдегида) = 12 ∙ 4 + 1∙ 8 + 16 = 74 г/моль.
Тогда масса m(альдегида) = ν(альдегида) ∙ М = 0.025 ∙ 74 = 1.85 г, что составляет
ω (альдегида) = 1.85 / 3.7 = 0.5 или 50% исходной смеси.
Задания для самостоятельной работы
8.1.Напишите уравнения реакций к схеме, укажите условия их протекания.
8.2.
8.3.
Предложите схему синтеза пропаналя из неорганических реагентов.
2. В немаркированных пробирках находятся 1) ацетон 2) этанол 3) фенол 4)этиленгликоль 5) уксусный альдегид. Посредством каких реакций можно определить содержимое каждой пробирки? Напишите уравнения реакций.
3. Для гидрирования некоторого количества смеси изомерных карбонильных соединений состава C4H8O требуется 17,92 л водорода (н.у.), в то время как при взаимодействии такого же количества смеси с гидроксидом меди (II) образуется 42,9 г красного осадка. Определите процентное содержание карбонильных соединений в смеси, напишите уравнения реакций.
4. Напишите уравнения реакций к схеме превращений. Раскройте механизм реакции, отмеченной символом*.

Контрольная работа “Карбонильные соединения” 21.02.09 вариант 2
1. Предложите схему синтеза бутаналя из неорганических реагентов.
2. В немаркированных пробирках находятся 1) бутанон-2 2) бутаналь 3) этиленгликоль 4) пропанол-2 5) фенол. Посредством каких реакций можно определить содержимое каждой пробирки? Напишите уравнения реакций.
3. При взаимодействии некоторого количества смеси бензальдегида и метилфенилкетона с аммиачным раствором оксида серебра получается осадок массой 3,24 г. То же количество смеси может вступить в реакцию с 400 мл 0,15 М раствора фенилмагнийбромида. Определите мольные доли компонентов в смеси, напишите уравнения реакций.
4. Напишите уравнения реакций к схеме превращений. Раскройте механизм реакции, отмеченной символом*.
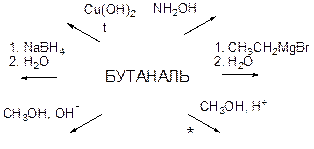
9. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
В данном разделе рассматриваются, в первую очередь, предельные одноосновные карбоновые кислоты. При этом несколько слов посвящено непредельным и многоосновным карбоновым кислотам. В качестве производных карбоновых кислот рассматриваются соли, сложные эфиры, ангидриды и галогенангидриды, амиды. Остальные производные: гидразиды, азиды, лактоны, лактамы и др. – являются предметом изучения университетского курса органической химии и в наше пособие не входят. Интересующиеся могут найти соответствующую информацию в учебниках для высшей школы.
К карбоновым кислотам принадлежат производные углеводородов, в молекулах которых присутствует карбоксильная группа COOH. В зависимости от природы радикала, связанного с карбоксильной группой, выделяют предельные, непредельные и ароматические карбоновые кислоты. В зависимости от количества карбоксильных групп выделяют одно-, двух-, трёх-… многоосновные карбоновые кислоты. Общая формула одноосновных предельных карбоновых кислот CnH2n+1COOH.
Номенклатура
Названия карбоновых кислот по международной номенклатуре получаются очень просто от названия углеводорода c тем же числом атомов углерода: этан – этановая кислота, 2‑метилпропан – 2‑метилпропановая кислота, 2,2-диметилпропан – 2,2-диметилпропановая кислота. К Вашему сожалению, такие названия обычно малоупотребимы: номенклатура карбоновых кислот большей частью основана на их тривиальных названиях. Основные из них придётся запомнить, остальные время от времени подглядывают в справочнике.
| HCOOH | CH3COOH | CH3CH2COOH | CH3(CH2)2COOH | (CH3)2CHCOOH |
| Муравьиная | Уксусная | Пропионовая | Масляная | Изомасляная |
| C4H9СOOH | C5H11СOOH | C6H13OOH | C7H15COOH | |
| Валериановая | Капроновая | Энантовая | Каприловая | |
| (COOH)2 | CH2(COOH)2 | (CH2COOH)2 | (CH2)3(COOH)2 | (CH2)4(COOH)2 |
| Щавелевая | Малоновая | Яблочная | Глутаровая | Адипиновая |
| (HOOC)CH(CH2COOH)2 | CH2=CHCOOH | CH3CH=CHCOOH | CH3(CH2)4(CH=CHCH2)4(CH2)2COOH | |
| Лимонная | Акриловая | Метакриловая | Арахидоновая – витамин F | |
| CH3(CH2)7CH=CH(CH2)7COOH | CH3(CH2)3CH2CH=CH)2(CH2)7COOH | CH3(CH2CH=CH)3(CH2)7COOH | ||
| Олеиновая | Линолевая | Линоленовая | ||
| CH3(CH2)14COOH | CH3(CH2)16COOH | |||
| Пальмитиновая | Стеариновая |
В остальном, принципы построения названий карбоновых кислот точно те же самые, что и для соединений других классов. За основу названия выбирают самую длинную цепь, содержащую карбоксильную группу, причём атома углерода карбоксильной группы получает номер 1. Соответствующий углеводород служит основой для построения названия, остальные функциональные группы перечисляют по алфавиту, указывая перед их названием номер атома углерода основной цепи, к которому они присоединены.
Замечание. В отечественной литературе вместо цифр ранее использовали буквы греческого алфавита. При этом атом углерода карбоксильной группы не нумеровали, соседний атом обозначали α, следующий за ним – β, затем γ, δ, ε,.. и т.д. по алфавиту. В настоящее время эти названия не используют.
Пример 1. Назовите по международной номенклатуре следующие соединения β‑хлоризомасляная кислота
Решение. Алгоритм должен быть Вам хорошо известен
| 1. Изображаем структурную формулу | 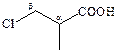
|
| 2. Выбираем самую длинную цепь, содержащую карбоксильную группу, если их длины равны – ту, в которой присутствуют заместители | 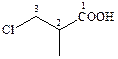
|
| 3. Нумеруем атомы углерода, начиная с группы COOH | |
| 4. Перечисляем заместители и их положение в цепи | 3-хлор-2-метил… |
| 5. Называем скелет карбоновой кислоты по числу атомов углерода в основной цепи | …пропан овая кислота |
Изомерия карбоновых кислот сводится, в основном, к структурной изомерии углеродного скелета, оптической изомерии (если она возможна, что определяется углеродным скелетом), межклассовой изомерии со сложными эфирами. Кроме того, можно изобразить ещё несколько изомеров, которые представляют собой более сложные соединения.
Пример 2. Изобразите возможные соединения разных классов, отвечающие брутто-формуле C4H8O2. Приведите все возможные изомеры, относящиеся к карбоновым кислотам и сложным эфирам.
Решение. Задача разбивается на 2 этапа: во-первых, изобразить все возможные карбоновые кислоты и сложные эфиры, во-вторых, показать возможные изомеры других классов. Лучше всего придерживаться определённой логики. Например, начнём с карбоновой кислоты линейного строения. Затем по очереди изобразим все изомеры, относящиеся к карбоновым кислотам. После чего изобразим метиловый эфир кислоты неразветвлённого строения – и повторим всю цепочку. Перейдём к этиловому эфиру и т.д. Этот подход гарантирует полный перебор всех необходимых структур.
Вторая часть задачи, видимо, предполагает изображение соединений разных классов. Для этого зафиксируем функциональную группу, присущую определённому классу, и изобразим изомер, содержащий подобную группу.
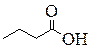
| 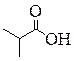
| 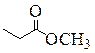
| 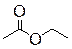
|
| Бутановая кислота | 2-Метилпропановая кислота | Метиловый эфир пропановой кислоты, Метилпропионат (Метилпропаноат) | Этиловый эфир уксусной кислоты, Этилацетат (Этилэтаноат) |
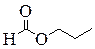
| 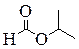
| 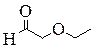
| 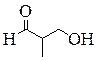
|
| н -Пропиловый эфир муравьиной кислоты, Пропилформиат (пропилметаноат) | Изо -Пропиловый эфир муравьиной кислоты, Изопропилформиат (изопропилметаноат) | 2-Этоксиэтаналь | 3-Гидрокси-2-метилпропаналь |
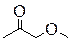
| 
| 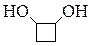
| 
|
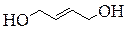
| Метоксипропанон | Бутанон-2-ол-1 | Циклобутандиол-1,2 | Бутен-2-диол-1,4 |
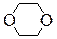
| 1,4-Диоксан | 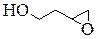
| 3-эпоксибутанол-1 |
В нашей табличке приведены соединения, содержащие карбонильную группу (C=O), двойную углерод-углеродную связь (C=C), гидроксильную группу (OH), фрагмент простого эфира (C-O-C), цикл, содержащий только атомы углерода, цикл, включающий 1 или 2 атома кислорода.
Физические свойства карбоновых кислот
Низшие карбоновые кислоты представляют собой жидкости с характерным запахом, высшие карбоновые кислоты (например, пальмитиновая, стеариновая) – твёрдые вещества. Температуры кипения карбоновых кислот выше, чем у соответствующих углеводородов и выше, чем у спиртов. Карбоновые кислоты способны к образованию межмолекулярных водородных связей. При этом даже в парах карбоновые кислоты могут находиться в димерном состоянии.
Химические свойства карбоновых кислот на основании строения молекул
Сосредоточим своё внимание на строении карбоксильной группы: нетрудно увидеть, что она представляет собой сочетание карбонильной группы (см. гл. «Альдегиды и Кетоны») и гидроксильной группы (см. гл. «Спирты»). В первом приближении Вы можете предсказать, что свойства карбоновых кислот в какой-то мере сочетают свойства карбонильных соединений и спиртов. В действительности, для предсказания свойств карбоновых кислот необходимо провести анализ взаимного влияния функциональных групп.
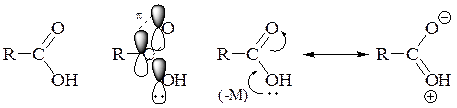
В молекуле карбоновой кислоты, например, уксусной, одна из двух неподелённых пар атома кислорода вступает в сопряжение с π-связью карбонильной группы. Благодаря дополнительному перекрыванию облаков возникает выигрыш в энергии. π-Связь, образованная парой электронов (по одному от каждого из атомов), взаимодействует с p -орбиталью атома кислорода гидроксильной группы, на которой находится неподелённая пара электронов. Происходит перераспределение электронной плотности, при котором π-связь выступает акцептором – проявляет отрицательный мезомерный эффект, что приводит к образованию четырёхэлектронной трёхцентровой π-связи и понижению электронной плотности на атоме кислорода гидроксильной группы.
Этот эффект может быть отражен резонансной структурой, в которой атом кислорода гидроксильной группы образует 3 ковалентные связи и несёт положительный заряд. Следовательно, связь O‑H ослабляется и отрыв протона облегчается. Поэтому уксусная кислота является более сильной кислотой, чем вода и, конечно, более сильной кислотой, чем спирт (см. пример).
Итак, карбоновые кислоты обладают высокой кислотностью (в сравнении с другими классами органических соединений).
Напротив, основные свойства атома кислорода гидроксильной группы понижены по сравнению со спиртами, в то время как основные свойства атома кислорода карбонильной группы усиливаются за счёт p - π -сопряжения.
Реакции нуклеофильного присоединения, характерные для альдегидов и кетонов, с карбоновыми кислотами идут с трудом: нуклеофильный реагент выступает, в первую очередь, как основание – и реакция идёт по атому водорода гидроксильной группы, а не по атому углерода карбонильной группы. Классическим примером реакции нуклеофильного присоединения является этерификация – взаимодействие со спиртами при кислотном катализе с образованием сложных эфиров. В щелочных условиях реакция не идёт (см. пример 4). В большинстве случаев реакции проходят как присоединение-отщепление. При этом в качестве уходящей группы выступает гидроксильная.
А вот для сложных эфиров реакции нуклеофильного присоединения-отщепления, напротив, реализуются легко, так как мешающий фактор (протон кислоты) устранён. Поэтому очень часто для получения производных карбоновой кислоты её предварительно превращают в сложный эфир. Этот приём можно рассматривать как «активацию» карбоксильной группы или, в более общем случае, как «активацию электрофила».
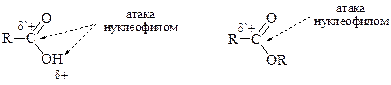
Другие способы активации заключаются в превращении карбоновой кислоты в ангидрид (в т.ч. галогенангидрид). При этом «плохая» уходящая группа – гидроксильная – превращается в галоген или остаток карбоновой кислоты – «хорошую» уходящую группу. Ангидриды карбоновых кислот (кроме фторангидридов) превосходят карбоновые кислоты по активности в реакциях с нуклеофильными реагентами. На самом деле, кислотный катализ в реакции этерификации тоже можно рассматривать как «улучшение» уходящей группы: при этерификации происходит отщепление не заряженной гидроксильной группы, а нейтральной молекулы воды.

Схема превращения карбоновой кислоты в производные
Восстановление карбоновых кислот может приводить к альдегидам и первичным спиртам. Восстановление карбоновых кислот проходит с трудом. Наиболее рациональным способом является восстановление производных карбоновых кислот. Так, реакция сложных эфиров с алюмогидридом лития приводит к спиртам, а каталитическое гидрирование хлорангидрида карбоновой кислоты при низкой температуре позволяет получить альдегид. Возможно восстановление карбоновой кислоты алюмогидридом лития, однако при этом часть реагента расходуется на реакцию с протоном кислоты (с выделением водорода), а образующаяся при этом соль восстанавливается медленно.
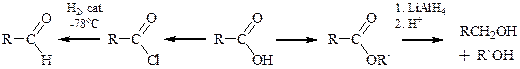
Замечание. Борогидрид натрия NaBH4 недостаточно активен для восстановления карбоксильной группы в карбоновых кислотах и сложных эфирах, что позволяет использовать его для селективного восстановления карбонильной группы альдегида или кетона в присутствии карбоксильной группы.
Наконец, в структуре карбоксильной группы можно увидеть фрагмент молекулы углекислого газа. Можно предположить, что существуют условия, при которых возможно декарбоксилирование – отщепление молекулы углекислого газа. И напротив, не исключено, что существует метод синтеза, при котором карбоновые кислоты могут быть получены посредством реакции некоторого субстрата с CO2.
Пример 3. Расположите следующие соединения в порядке возрастания кислотности: муравьиная кислота, масляная кислота, хлоруксусная кислота, пропионовая кислота, уксусная кислота, трифторуксусная кислота.
Решение. В первую очередь требуется изобразить формулы соединений, которые заданы в условии задачи.
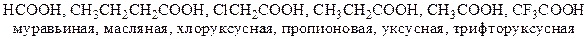
В чём отличие этих молекул? В заместителе, который примыкает к карбоксильной группе! Следовательно, его эффект оказывает влияние на величину кислотности. Эффекты бывают электронные (передача и перераспределение электронной плотности) и пространственные. Последние в нашем случае не при чём, так как гибридизация атома углерода карбоксильной группы sp2 – и заместитель направлен в другую сторону от гидроксильной группы (под углом 120°). Точно такой же алгоритм следует использовать для всех подобных задач для соединений одного класса.
В ряду муравьиная – уксусная – пропионовая – масляная кислота кислотность снижается, так как возрастает положительный индуктивный эффект со стороны углеводородного радикала. У муравьиной кислоты эффект заместителя равен 0 (атом водорода), у остальных – больше 0. Это приводит к накоплению большей электронной плотности на атоме кислорода гидроксильной группы, следовательно, к упрочению связи O-H. Значит, протон отщепляется сложнее – и кислотность снижена. Дальнейшее увеличение длины углеводородного радикала оказывает слабое влияние на кислотность, т.к. индуктивный эффект «короткодействующий» - его силы хватает не более, чем на 2-3 связи.
Введение атома галогена (фтора, хлора) в состав углеводородного радикала приводит к возрастанию кислотности по сравнению с незамещённой кислотой. Атом галогена обладает сильным отрицательным индуктивным эффектом, что приводит к понижению электронной плотности на атоме кислорода и уменьшению прочности связи O-H. Наибольшей кислотностью обладает трифторуксусная кислота, хлоруксусная кислота слабее.
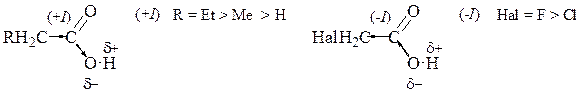
Пример 4. Раскройте механизм реакции уксусной кислоты с метиловым спиртом.
Решение. Реакция уксусной кислоты с метиловым спиртом приводит к получению метилацетата – сложного эфира – и носит название этерификация. Катализатором выступает кислота, обычно серная. Кислота диссоциирует с образованием протона, который и является катализатором данного превращения.
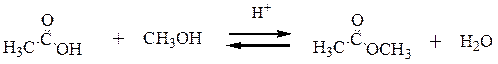
Как уже обсуждалось выше, наиболее основным является атом кислорода карбонильной группы. Поэтому именно он протонируется легче всего. Протонирование приводит к активации карбоксильной группы к нуклеофильной атаке, что может быть проиллюстрировано резонансной структурой, в которой на атоме углерода находится положительный заряд. Активированная протонированием карбоновая кислота подвергается атаке нуклеофилом (неподелённой парой атома кислорода спирта). В образующемся аддукте происходит последовательное отщепление-присоединение протона и элиминирование молекулы воды. Образующийся карбокатион стабилизирован положительным мезомерным эффектом двух атомов кислорода. После элиминирования протона (регенерирование катализатора) образуется продукт реакции.
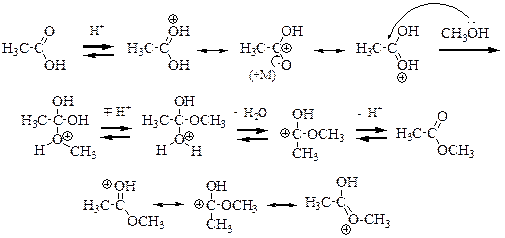
Побочным процессом является протонирование спирта, которое приводит к дезактивации нуклеофила. Следовательно, существует оптимальное значение кислотности среды, при котором следует проводить реакцию.
Все стадии процесса обратимы, движущей силой процесса является низкая концентрация эфира. Смещения равновесия в сторону образования эфира достигают двумя способами: проведением реакции в избытке спирта или отгонкой образующегося сложного эфира.
Обратный процесс называется гидролизом сложного эфира в кислой среде и проходит через те же стадии
Замечание. Метод меченых атомов. Реакция этерификации а также гидролиз сложных эфиров в кислой и щелочной средах являются одними из немногих реакций, для которых механизм установлен с высокой степенью достоверности. Одним из способов, использованных для этой цели, являлся метод меченых атомов. В чём он заключается?
Для реакции используют спирт, меченый по гидроксильной группе изотопом 18O. Продукты реакции анализируют: в какой продукт и в какое положение попал тяжёлый атом кислорода? Таким способом удаётся доказать, что процесс происходит как нуклеофильное присоединение к карбонильной группе, а не электрофильное замещение при атоме кислорода гидроксильной группы.
Методы получения карбоновых кислот
Методы получения карбоновых кислот представлены на схеме. Они включают в себя окисление алкенов, алкинов, первичных спиртов, альдегидов, кислотный гидролиз нитрилов, реакцию галоформного распада, взаимодействие реактивов Гриньяра с углекислым газом, гидролиз тригалогеналканов.
| Методы получения карбоновых кислот основаны, в первую очередь, на реакциях окисления различных органических соединений: алкенов, алкинов, спиртов, альдегидов. Главной проблемой этих реакций является подбор реагента и условий реакции. Так, в большинстве случаев процесс проходит в жёстких условиях, при нагревании с сильным окислителем. Разумеется, при этом появляются ограничения на те функциональные группы, которые можно сохранить в молекуле субстрата в условиях реакции и «перенести» в молекулу карбоновой кислоты. Другой проблемой является образование побочных продуктов, например, продуктов неполного окисления. | 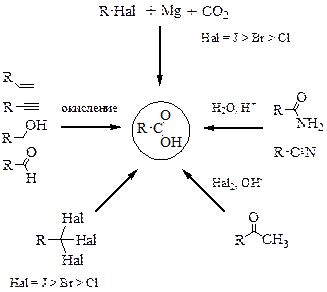
|
В этой связи в органическом синтезе обычно избегают реакции окисления в жёстких условиях. Рекомендовать можно хорошо знакомые реакции окисления альдегидной функции – альдегиды окисляются легко, в мягких условиях, что позволяет проводить реакцию селективно.
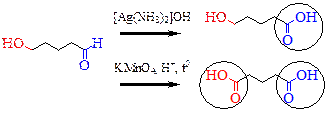
| Например, можно превратить альдегидную группу в карбоксильную в присутствии гидроксильной группы спирта, но нельзя превратить спиртовую группу в карбоновую кислоту, без затрагивания альдегидной функции. |
Другим удобным и полезным способом создания карбоксильной группы является кислотный гидролиз нитрилов в кислой среде при нагревании. Реакцию можно остановить на стадии образования амидов. Нитрильную группу вводят реакцией нуклеофильного замещения атома галогена. Недостатком является использование солей синильной кислоты – цианид калия или натрия (цианистого калия, цианистого натрия). Эти соединения – сильные яды!
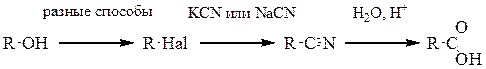
Реакция кетонов с хлором или бромом в щелочной среде носит название галоформного распада и имеет ограниченное применение, однако, может быть использована в синтезе. Региоселективность реакции достигается за счёт более высокой кислотности протонов концевой метильной группы (предполагается, что R отлично от CH3). Побочным продуктом реакции является хлороформ (CHCl3) или бромоформ (CHBr3).
Взаимодействие реактива Гриньяра с углекислым газом является удобным способом получения карбоновых кислот, однако требует применения абсолютных растворителей, контроля подачи газа в реактор. При этом в исходном субстрате не может быть ни гидроксильной группы (превращают в эфирную), ни карбонильной (превращают в ацеталь или кеталь), ни карбоксильной группы, так как реактив Гриньяра с ними реагирует. Поэтому этот метод накладывает жёсткие ограничения на функциональные группы субстрата.
Гидролиз тригалогеналканов как метод получения карбоновых кислот малоприменим в связи с малой доступностью исходных соединений.
Пример 5. Предложите метод получения адипиновой (1,6-гександикарбоновой) кислоты из неорганических реагентов.
Решение. Помните, какой вопрос надо задавать себе в самом начале решения? Какая стадия была последней в синтезе этого вещества?
В целом для решения этой задачи возможны две принципиально разных схемы: одновременное или последовательное создание карбоксильных групп. В пользу одновременного свидетельствует довольно высокая активность карбоксильной группы (или сложноэфирной группы), которая препятствует проведению ряда реакций. Например, нельзя получить реактив Гриньяра, содержащий сложноэфирную группу. Однако удалённость карбоксильных групп друг от друга предполагает, что возможна стратегия последовательного их введения. Привлекательной выглядит симметрия молекулы, которую, вероятно, можно использовать в синтезе.
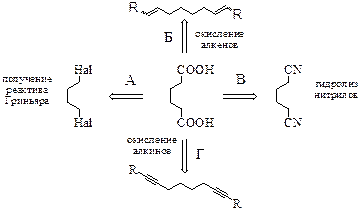
| Одновременное создание карбоксильных групп может быть проиллюстрировано схемой, приведённой слева. Вариант А предполагает построение углеродного скелета, способ В – превращение функциональной группы, в то время как методы Б и Г основаны на реакциях окисления углеродного скелета. Попробуем реализовать каждую стратегию. |
Стратегии А и В, на самом деле, сводятся к одной и той же проблеме – получению 1,4-дигалогенбутана, что является непростой задачей.
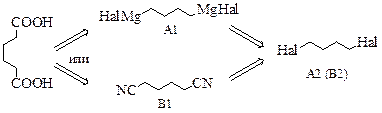
1,4-Расположение атомов галогенов в структуре А2 представляет серьёзную проблему. Поэтому постараемся её обойти. Мы знаем, что 1,4-расположение достигается при присоединении эквимольного количества реагента к сопряжённым алкадиенам в условиях термодинамического контроля. Используем этот приём. Тогда в ходе синтеза получится непредельная карбоновая кислота, которую мы восстановим и получим целевое соединение.
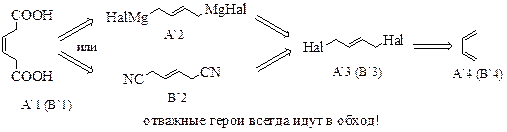
Бутадиен является промышленным продуктом, что обеспечивает его невысокую стоимость, и может быть получен, например, по методу Лебедева. Этиловый спирт получают гидратацией этилена, который может быть получен неполным гидрированием ацетилена.
Стратегии окисления. Успешная их реализация заключается в правильном выборе предшественника. Реакция окисления должна быть, по возможности, максимально селективна, продукты реакции должны легко разделяться.
В качестве предшественника для стратегии Г мы выбрали октадиин-1,7. При его окислении должен получиться целевой продукт и углекислый газ. И в этот момент оказывается, что предшественником структуры Г1 является тот же самый 1,4-дигалогенбутан! Его реакция с ацетиленидом щелочного металла приведёт к соединению Г1. Таким образом стратегия Г сводится, по сути, к вариантам А и В.
Исходным вещество для стратегии Б хорошо выбрать циклогексен, содержащий ровно столько же атомов углерода, сколько и целевой продукт. Циклогексен легко получается из галогенциклогексана, который можно получить из циклогексана. Последний доступен при гидрировании бензола.
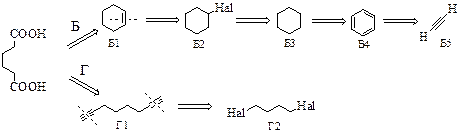
Таким образом, синтез целевой структуры (стратегия Б):
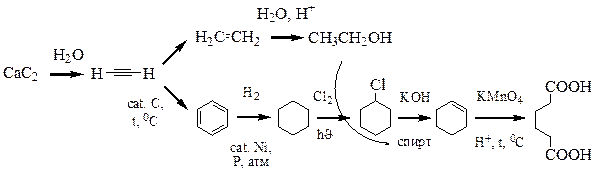
Или с использованием альтернативного плана (стратегии А, В, Г):
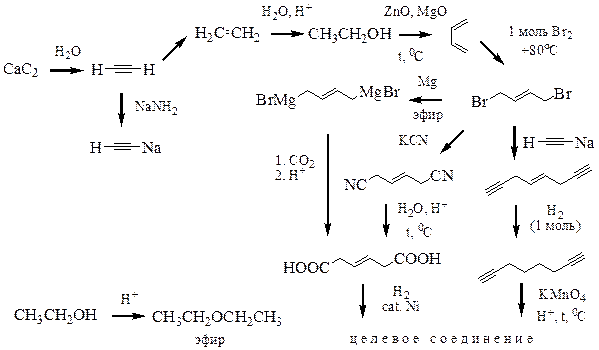
Анализ представленной схемы позволяет найти возможные проблемы. Бумага всё стерпит, а на практике?
Во-первых, сомнительным представляется путь, включающий образование двойного реактива Гриньяра.
Гидролиз нитрилов проходит в жёстких условиях, при которых возможны реакции по двойной связи, например, гидратация или изомеризация. Поэтому, вероятно, лучше сначала гидрировать динитрил и лишь потом проводить его гидролиз. Однако на этом этапе требуется контроль условий, так как нитрильная группа также чувствительна к реакциям восстановления.
Последний путь наталкивается на проблему селективного восстановления двойной связи без затрагивания тройных связей. Двойная связь легче подвергается гидрированию, что теоретически обеспечивает селективность. Тем не менее, на практике потребуется подбор условий для реализации этого процесса.
Таким образом, предпочтительной стратегией является путь Б.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3468; Нарушение авторских прав?; Мы поможем в написании вашей работы!