
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Качественные реакции на функциональные группы
|
|
|
|
| Функциональная группа | Реагент, условия | Продукты реакции | Признаки реакции | Примечание |

| KMnO4, H2O, 0°C |  , MnO2 , MnO2
| Обесцвечивание, бурый осадок MnO2 | Окисление алкенов в мягких условиях |

| Br2, H2O | 
| Обесцвечивание | |

| KMnO4, H2SO4 | 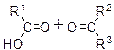
| Обесцвечивание | Окисление алкенов в жёстких условиях |

| Br2, H2O | 
| Обесцвечивание | |
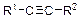
| KMnO4, H2SO4 | 
| Обесцвечивание | |
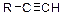
| [Ag(NH3)2]OH [Cu(NH3)2]Cl | 
| Осадок ацетиленида металла | Кислотные свойства алкинов-1 |
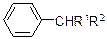
| KMnO4, H2SO4, кипячение | 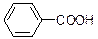
| Обесцвечивание | Другие продукты определяются R1 и R2 |

| Na | 
| Растворение натрия, выделение газа | |

| CuO | 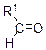
| Чёрная окраска CuO меняется на красную (Cu или Cu2O) | |
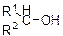
| CuO | 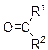
| То же | |

| CuO | Нет реакции | ||

| KMnO4, H2SO4 | 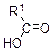
| Обесцвечивание | |
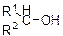
| KMnO4, H2SO4 | 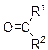
| Обесцвечивание | |

| KMnO4, H2SO4 | Нет реакции | ||

| Cu(OH)2, NaOH | Хелатный комплекс | Растворение осадка Cu(OH)2, образование синего раствора | |

| Br2, H2O | 
| Обесцвечивание раствора, белый осадок | |

| FeCl3 | Комплексное соединение | Фиолетовый раствор | |
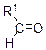
| [Ag(NH3)2]OH, нагревание | 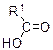
| «Серебряное зеркало», осадок Ag | |
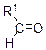
| Cu(OH)2, нагревание | 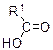
| Жёлтый осадок CuOH, далее при нагревании красный Cu2O | |

| NaHCO3 | 
| Выделение газа (CO2), вызывающего помутнение известковой воды | |
| R1R2R3N | HCl | R1R2R3NH+Cl- | Белый осадок гидрохлорида амина | |

| Br2, H2O | 
| Обесцвечивание раствора, белый осадок |
Содержание
От авторов. 3
7. ОДНОАТОМНЫЕ И МНОГОАТОМНЫЕ СПИРТЫ, ФЕНОЛЫ... 4
Номенклатура и изомерия. 4
Взаимосвязь строения спиртов и их свойств. 6
Химические свойства спиртов. 8
Природа основного катализа. 9
Природа кислотного катализа. 10
Реакции нуклеофильного замещения при насыщенном атоме углерода. 10
Реакции элиминирования. 14
Химические свойства многоатомных спиртов. 16
Химические свойства фенолов. 17
Методы получения. 17
Качественные реакции. 18
Задания для самостоятельной работы. 23
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ.. 27
8. АЛЬДЕГИДЫ И КЕТОНЫ... 27
9. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ.. 28
Номенклатура. 28
Физические свойства карбоновых кислот. 30
Химические свойства карбоновых кислот на основании строения молекул.. 30
Методы получения карбоновых кислот. 34
ЖИРЫ... 37
Задания для самостоятельной работы. 37
10. УГЛЕВОДЫ... 39
Классификация и номенклатура углеводов. 40
Кольчато-цепная таутомерия. 41
Химические свойства углеводов. 42
Качественные реакции. 43
УКАЗАНИЯ И ОТВЕТЫ... 44
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ФУНКЦИОНАЛЬНЫЕ ГРУППЫ... 52
Содержание.. 54
[1] В этой же главе мы коснёмся такого класса органических соединений, как простые эфиры.
[2] Под функциональной группой понимают особенность строения органического соединения, которая позволяет отнести его к определенному классу (двойная углерод-углеродная связь C=C, тройная углерод-углеродная связь C≡C, гидроксильная группа OH, карбонильная группа C=O и др.).
[3] Для образования водородной связи есть 2 условия: наличие атома водорода, связанного с электроотрицательным элементом (обычно F, O, N) и наличие электроотрицательного атома (обычно F, O, N) в другой молекуле. В молекулах спиртов такие условия есть O-H····: O(H)R
[4] Кислотность в газовой фазе определяется устойчивостью свободных ионов и тем выше, чем больше степень делокализации отрицательного заряда в образующемся анионе. В этой связи этиловый спирт окажется менее сильной кислотой, чем трет -бутиловый.
[5] В данном случае мы рассматриваем эффект π‑системы на атом кислорода, поэтому эффект (-М). Эффект атома кислорода на π‑систему имеет обратный знак (+M).
[6] Фенол раньше даже называли карболовой кислотой (карболкой), а первое его применение как антисептика в медицине (Дж. Листер) произвело подлинную революцию в хирургии. Сейчас фенол не используют, так как показана высокая токсичность этого соединения.
[7] Под мысленным экспериментом понимают такой, в котором для решения задачи представляют определенные условия опыта, и посредством рассуждений приходят к выводу о его результате.
[8] Такой прием можно рассматривать как активацию нуклеофила.
[9] Данное рассуждение не вполне корректно, так как сравнение проводится для разных сред – воды и спирта – в результате чего мы с Вами забываем о влиянии растворителя – различной сольватации веществ в этих средах. На самом деле, сольватация имеет огромное значение и не может быть исключена из рассмотрения.
[10] Под лимитирующей стадией обычно подразумевают самую медленную стадию процесса, так как именно она определяет его скорость (процесс не может идти быстрее, чем самая медленная из стадий, из которых он состоит).
[11] Таким образом, возникает равновесие между протонированным спиртом и карбокатионом. Обратный процесс, потому что быстрый, успевает «подстроиться» под равновесие.
[12] Типичными основаниями являются n BuLi – н -бутиллитий, LDA – ди(изопропил)амид лития, t BuOK – трет -бутилат калия, этилат натрия, метилат натрия (в порядке уменьшения силы основания). Сила основания увеличивается в ряду C‑ > N‑ > O‑ > Hal-, CH3CH2- > CH3NH- > CH3O- > OH- > Cl-.
[13] Подобный процесс получил название сольволиза – в роли нуклеофильного реагента выступает растворитель (англ. solvent).
[14] На данном этапе мы упростили задачу: из n соединений осталось n-1. Получается алгоритм, который на каждом шаге сводит задачу к более простой.
[15]Другие названия: бромистый бензил, α-бромтолуол, бромметилбензол
[16] их как раз проще получить из карбонильных соединений и галогенидов фосфора(V)
[17] Гидратация по реакции Кучерова пентина-2 приводит к смеси пентанона-2 и пентанона-3.
[18] ЗАМЕЧАНИЕ: Учтите, Вам неизвестно, что в какой пробирке находится, поэтому Вам нужно написать, что происходит при добавлении реагента X к каждому из веществ. Например: Пробирка 1 + X = продукты реакции, наблюдаемые изменения, вывод: содержимое пробирки – этиловый спирт. Пробирка 2 + X = реакция не идёт. И т.д. Естественно, что если Вы уже определили какое-то соединение, то дальше его истязать не стоит J.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1854; Нарушение авторских прав?; Мы поможем в написании вашей работы!