
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения
|
|
|
|
12.1. Структура и номенклатура комплексных соединений.
В структуре комплексных соединений выделяют внещнюю сферу и внутреннюю сферу, состоящую из комплексообразователя и лигандов. Комплексообразователями могут быть катионы и нейтральные атомы d-элементов, а также ионы s-, p-элементов, в том числе и неметаллов. Лигандами являются ионы или молекулы, координированные вокруг центрального атома во внутренней сфере. Число мест, занимаемых лигандами, называется координационным числом, а число мест, занимаемых каждым лигандом во внутренней сфере комплекса, определяет его координационную емкость (к.е.)
Если к.е. = 1, то лиганды монодентатные, например: OH–, Hal–, CN–, H2O, NH3 и др. Если к.е. = 2 и более, то лиганды би- и полидентатные, например: 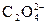 ,
, 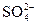 ,
, 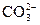 , NH2CH2CH2NH2, NH2CH2COO–, ЭДТА и др.
, NH2CH2CH2NH2, NH2CH2COO–, ЭДТА и др.
Согласно номенклатуре лиганды перечисляются в следующем порядке: анионные, нейтральные, катионные. Порядок перечисления анионов: Н–, О2–, ОН–, одноатомные анионы, полиатомные анионы, органические анионы в алфавитном порядке. Анионные комплексы имеют окончания «ат» или «овая» для кислот. Степень окисления комплексообразователя равна алгебраической сумме зарядов внешних ионов и лигандов, взятой с противоположным знаком. Ее величина указывается римской или арабской цифрой.
Пример: Определите степень окисления комплексообразователя и назовите следующие соединения: а) [Pt(NH3)3Cl]Br, б) K3[Fe(CN)6];
в) [Co(NH3)3Cl3].
Решение:
а) [Pt(NH3)3Cl]Br
Сумма зарядов лигандов (NH3, Cl–) и внешнесферных ионов (Br–) равна: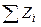 = (–1)+(–1) = –2
= (–1)+(–1) = –2
Степень окисления комплексообразователя равна +2.
Бромид хлородиамминплатины(II).
б) K3[Fe(CN)6]
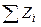 = 3(+1) + 6(–1) = –3; с.о. (Fe) = +3
= 3(+1) + 6(–1) = –3; с.о. (Fe) = +3
Гексацианоферрат(III) калия.
в) [Co(NH3)3Cl3]
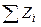 = 3×0 + 3(–1) = –3; с.о. (Со) = +3.
= 3×0 + 3(–1) = –3; с.о. (Со) = +3.
Трихлоротриамминкобальт(III).
12.2. Равновесие в водных растворах комплексных соединений. Устойчивость комплексных соединений.
Внешнесферная ионизация комплексных солей происходит в водных растворах практически полностью по типу сильных электролитов (первичная ионизация):
[Ag(NH3)2]Cl ® [Ag(NH3)2]+ + Cl–
Образующиеся комплексные ионы являются слабыми электролитами, их ионизация происходит ступенчато (вторичная ионизация). Установившееся при этом равновесие характеризуется константой равновесия, называемой константой нестойкости (Кн):
[Ag(NH3)2]+ Û [Ag(NH3)]+ + NH3 (I ступень)
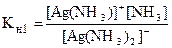
[Ag(NH3)]+ Û Ag+ + NH3 (II ступень)
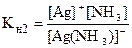
Общая константа нестойкости равна произведению ступенчатых констант нестойкости:
Кн = Кн1×Кн2 =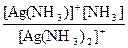 ×
×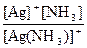
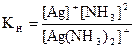
Константу равновесия процесса комплексообразования называют константой устойчивости (Ку):
Ag+ + 2NH3 Û [Ag(NH3)2]+

Чем устойчивее комплексный ион, тем меньше его константа нестойкости и больше константа устойчивости.
Пример: Сравните устойчивость комплексных ионов: [Ag(NO2)2]–, [Ag(CN)2]–, [Ag(NH3)2]+, [AgCl2]–.
Решение:
Устойчивость однотипных комплексных ионов можно сравнить путем сопоставления величин Кн, взятых из таблиц:
Кн[Ag(NO2)2]– =1,3×10–3; Кн[Ag(CN)2]– =8×10–21; Кн[Ag(NH3)2]+ =5,7×10–8; Кн[AgCl2]– =1,76×10–5.
Наиболее сильным электролитом будет [Ag(CN)2]–, а наиболее слабым – [Ag(NO2)2]–.
Общие константы нестойкости используют при расчетах концентраций в растворах комплексных соединений при избытке лигандов.
Пример: Вычислите концентрацию ионов кадмия в 0,1М растворе К2[Cd(CN)4], содержащем в избытке 0,1 моль KCN в литре раствора. Кн[Cd(CN)4]2– = 1,41×10–19.
Решение:
В присутствии избытка CN– равновесие процесса ионизации смещено влево. Концентраций CN–, образующихся при диссоциации комплексного аниона, можно пренебречь. Поэтому можно считать, что [CN–] = c(KCN) = 0,1 моль/л. По этой же причине равновесную концентрацию [Cd(CN)4]2– условно можно приравнять к общей концентрации комплексной соли.
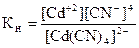 , отсюда
, отсюда
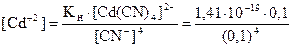 = 1,41×10–16 моль/л.
= 1,41×10–16 моль/л.
12.3. Химические свойства комплексных соединений.
Реакции с участием комплексных соединений возможны, если добавляемый реагент осаждает малорастворимую соль или вызывает образование слабого электролита, в том числе более прочного комплексного иона. При этом происходит более полное связывание комплексообразователя или лиганда, так что концентрации этих частиц, остающихся в растворе не связанными, принимают минимальные значения.
Пример. Определите, в каких случаях произойдет взаимодействие между растворами электролитов: а) [Zn(NH3)4]Cl2 + 4KCN ® K2[Zn(CN)4] + 4NH4Cl;
б) K2[HgI4] + 4KBr = K2[HgBr4] + 4KI.
Решение:
а) [Zn(NH3)4]Cl2 + 4KCN ® K2[Zn(CN)4] + 4NH4Cl
Кн[Zn(NH3)4]2+ = 8,32×10–10; Кн[Zn(CN)4]2– = 2,4×10–20.
Взаимодействие возможно, так как
Кн[Zn(NH3)4]2+ > Кн[Zn(CN)4]2–, то есть происходит более полное связывание ионов Zn+2 в прочный комплексный ион.
б) K2[HgI4] + 4KBr = K2[HgBr4] + 4KI
Kн[HgI4] = 1,48×10–30; Кн[HgBr4] = 10–21.
Реакция невозможна, так как ионы ртути более прочно связаны в тетрайодомеркурат-анионе.
Для решения вопроса о возможности разрушения комплексного иона за счет связывания комплексообразователя в малорастворимую соль необходимо оценить значения равновесных концентраций ионов в рассматриваемой системе.
Пример. Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1М раствора [Ag(NH3)2]NO3, содержащему 1 моль аммиака: а) 1×10–5 моль KBr; б) 1×10–5 моль KI?
Решение:
Кн[Ag(NH3)2]+ = 6,8×10–8; Кs(AgBr) = 5,3×10–13; Ks(AgI) = 8,3×10–17.
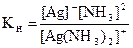
Условно можно принять, что [NH3] @ c(NH3) = 1 моль/л,
[Ag(NH3)2]+ @ с([Ag(NH3)2)]NO3 = 0,1 моль/л. Концентрация ионов Ag+ равна:
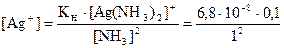 = 6,8×10–9 моль/л;
= 6,8×10–9 моль/л;
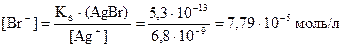
Так как необходимая для осаждения AgBr концентрация ионов Br– больше добавляемой в составе KBr, то реакция в данном случае протекать не будет.
б) Концентрация ионов I–, достаточная для осаждения AgI, равна:
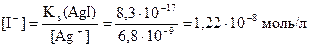
Так как необходимая для осаждения AgI концентрация I– меньше добавляемой в составе KI, то реакция в данном случае будет протекать и комплексный ион разрушается:
[Ag(NH3)2]NO3 + 2KI ® AgI + KNO3 + 2NH3.
12.4. Пространственная структура комплексных соединений. Магнитные свойства.
Существует два основных подхода к описанию химической связи в комплексных соединениях: а) метод валентных связей; б) теория кристаллического поля.
а) Метод валентных связей
При образовании комплексов между комплексообразователем и лигандами возникают ковалентные связи по донорно-акцепторному механизму за счет неподеленных электронных пар лигандов, которые занимают свободные гибридные орбитали комплексообразователя. Вид гибридизации и структура комплекса определяется электронным строением центрального иона и природой лигандов.
Таблица
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 4550; Нарушение авторских прав?; Мы поможем в написании вашей работы!