
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы. Способы выражения концентрации
|
|
|
|
Вопросы к контрольной работе
для студентов I курса заочной формы обучения
фармацевтического факультета
1. Основные способы приготовления растворов из фиксаналов, по навеске реактива, разбавлением более концентрированного раствора данного вещества. Как приготовить растворы, используемые в медико-санитарной практике: а) 0,1М HCl; б) 0,9% NaCl; в) 5%NH3*H2O;
г) 0,1н (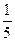 КMnO4); д) 0,1н. NaOH.
КMnO4); д) 0,1н. NaOH.
2. Способы выражения концентрации растворов: массовая доля, молярная концентрация. Применение в медицине. Рассчитайте массовую долю вещества в растворе с молярной концентрацией уксусной кислоты
5,6 моль/л (r = 1,034 г/мл).
3. Способы выражения концентрации растворов: молярная концентрация эквивалента, титр. Молярная концентрация окислителя в растворе равна
0,03 моль/л. Определите молярную концентрацию эквивалента окислителя, принимая во внимание химизм реакции:
KMnO4 + H2O2 + H2SO4 ® MnSO4 + …
4. Дайте определение: «раствор», «растворитель», «растворенное вещество». Ответ поясните на примерах. Какой объем 0,1М раствора Н3РО4, можно приготовить из 85 мл раствора с молярной концентрацией эквивалента Н3РО4 равной 0,75н. (f (Н3РО4) = 1/3)?
5. Сколько миллилитров концентрированной соляной кислоты с массовой долей 40% и r = 1,198 г/мл следует взять для приготовления 1,0 л 2,5н. HCl? Опишите способ приготовления растворов методом разбавления концентрированных растворов.
6. Кальций хлорид используется как кровоостанавливающиее средство. Как приготовить 200 мл 3% раствора СаCl2 из кристаллического СаCl2*6Н2О, если плотность полученного раствора 1,0 г/мл? Какова молярная концентрация СаCl2 в полученном растворе. Опишите способ приготовления растворов из фиксаналов.
7. В 2,5 л раствора содержится 18,55 г алюмокалиевых квасцов KAl(SO4)3*12H2O. Рассчитайте: а) молярную концентрацию квасцов в растворе; б) молярную концентрацию эквивалента квасцов в растворе (f квасцов = 1/4). Опишите способ приготовления растворов из навески твердого вещества.
8. Рассчитайте массу кристаллического натрий хлорида, которая необходима для приготовления раствора с молярной концентрацией натрий хлорида 0,75М. Выразите концентрацию приготовленного раствора через массовую долю и титр (r = 1,034 г/мл). Опишите способ приготовления такого раствора.
9. Какой объем 0,1М раствора Н3РО4, можно приготовить из 40 мл раствора с молярной концентрацией эквивалента Н3РО4, равной 0,9 моль (f (Н3РО4) = 1/3)?
10. Вычислите молярную концентрацию и молярную концентрацию эквивалента H2SO4 в растворе, если массовая доля H2SO4 в этом растворе равна 58% (r = 1,48 г/мл). Медико-биологичес-кое значение растворов.
11. Молярная концентрация натрия карбоната в растворе 0,15 моль/л (r = 1,0 г/мл). Вычислите молярную концентрацию эквивалента, титр и массовую долю Na2CO3 в растворе. Дайте определение понятию «моляльность раствора».
12. При некоторых заболеваниях в кровь вводят 0,9% раствор NaCl (r =
1 г/мл). Вычислите: а) молярную концентрацию и титр этого раствора; б) массу соли, введенную в организм при вливании 600 мл этого раствора.
13. К 100 мл 96% (по массе) H2SO4 (r = 1,84 г/мл) прибавили 410 мл воды, получили раствор с r = 1,22 г/мл. Вычислите молярную концентрацию эквивалента и массовую долю H2SO4 в этом растворе с учетом, что (f (Н2SО4) = 1/2). Каким способом приготовлен этот раствор? Опишите методику приготовления такого раствора.
14. 5 мл раствора с молярной концентрацией H2SO4 1 моль/л разбавили водой до 250 мл. Рассчитайте w(H2SO4); c(H2SO4) и c(1/2H2SO4) для полученного раствора, если его плотность равна 1 г/мл.
15. Найдите молярность и моляльность 36,2% (по массе) раствора HCl, плотность которого 1,18 г/мл. Сколько мл этого раствора необходимо взять для приготовления 5 л 0,1н. раствора HCl?
16. Какой объем 2 н. раствора H2SO4 потребуется для приготовления 500 мл 0,5н. раствора? Дайте определения понятиям: эквивалент, фактор эквивалентности, количество вещества эквивалента, молярная концентрация эквивалента. (fэк(H2SO4) =  )
)
17. Найдите массу NaNO2, необходимую для приготовления 300 мл 0,2М раствора. Опишите способ приготовления такого раствора из навески твердого вещества.
18. Плотность 40% (по массе) раствора HNO3 равна 1,25 г/мл. Рассчитайте молярность, моляльность и титр этого раствора. Как приготовить раствор из фиксанала?
19. 6,8 г карбоната натрия растворили в 104 г воды. Вычислите массовую и молярную доли растворенного вещества в растворе. Опишите способ приготовления раствора с определенной массовой долей растворенного вещества.
20. Найдите моляльность и молярную долю растворенного вещества в 67%-ном (по массе) растворе сахарозы С12Н22О11. Дайте определение понятиям «молярная концентрация эквивалента» и «молярная концентрация».
21. В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114 г Al2(SO4)3. Опишите способы приготовления этих растворов.
22. Какой объем 6,0М раствора HCl нужно взять для приготовления 25 мл 2,5М раствора HCl. Определите титр полученного раствора.
23. Рассчитайте молярную массу эквивалента: а) фосфорной кислоты в реакции полного обмена протонов; б) сульфата железа(III) в реакции полного обмена ионов железа; в) гидрокарбоната кальция в реакции частичного обмена ионов кальция; г) дигидрофосфата аммония в реакции частичного обмена протонов.
24. При отравлениях цианидами внутривенно вводят 2%-ный раствор нитрата натрия (r = 1,011 г/мл). Вычислите молярную концентрацию, титр и моляльность этого раствора.
25. Водный раствор сульфата меди с массовой долей 1% (r = 1,009 г/мл) назначают в малых дозах для улучшения кроветворной функции. Рассчитайте молярную концентрацию, молярную концентрацию эквивалента, титр и моляльность этого раствора?
26. Какую массу калий бромида нужно прибавить к 5 кг 16% раствора, чтобы получить 20% раствор? Рассчитайте молярную концентрацию и молярную концентрацию эквивалента полученного раствора?
27. Сколько граммов 30% раствора гидроксида калия надо прибавить к 200 г 90% раствора, чтобы получить 50% раствор гидроксида калия?
28. В лаборатории имеются растворы с массовой долей хлорида натрия 10% и 20%. Какую массу каждого раствора надо взять для получения 300 г раствора с массовой долей соли 12%?
29. Какой объем раствора с массовой долей серной кислоты 60% (r =
1,5 г/мл) и раствора с массовой долей серной кислоты 30% (r = 1,2 г/мл) надо взять для приготовления раствора H2SO4 массой 240 г с массовой долей кислоты 50%?
30. Какие объемы раствора NaCl с w1 = 5% и w2 = 24% нужно взять для приготовления 250 мл раствора с w3 = 18%? (r1 = 1,03 г/мл; r2 =
1,18 г/мл; r3 = 1,13 г/мл).
31. Определите массу раствора с массовой долей CuSO4 10% и массу воды, которые требуются для приготовления раствора массой 500 г с массовой долей CuSO4 2%.
32. Какая масса воды и раствора с массовой долей хлорида магния 0,2 потребуется для приготовления 300 г раствора с массовой долей MgCl2 0,04?
33. На нейтрализацию 40 мл раствора едкого натра израсходовано 25 мл
0,5 н. раствора серной кислоты. Определите молярную концентрацию эквивалента едкого натра.
34. Сколько литров 0,03 н. раствора Н3РО4 способно прореагировать с 250 г
4%-ного раствора NaOH с образованием дигидроортофосфата натрия?
35. Какой объем 3 н. раствора H2SO4 требуется для нейтрализации 8,415 г КОН?
36. Сколько граммов Na2CO3 требуется для взаимодействия с 600 мл 0,5 н. раствора HNO3?
37. Какой объем 4 н. раствора HCl требуется для нейтрализации 10 г NaOH?
38. Сколько граммов 5%-ного раствора AgNO3 требуется для обменной реакции со 120 мл 0,6 н. AlCl3?
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2046; Нарушение авторских прав?; Мы поможем в написании вашей работы!