
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Учение о растворах. Протолитические и гетерогенные равновесия
|
|
|
|
123. Сильные и слабые электролиты. Степень диссоциации, факторы, влияющие на степень диссоциации. Вычислите степень ионизации (a): а) в 0,5%-ном растворе HNO2 (пл. 1 г/мл; Ка(HNO2) = 4,0*10–4;
б) в 0,02 н. растворе НСООН (Ка(НСООН) = 1,77*10–4).
124. Понятие о константе электролитической диссоциации. От каких факторов и как зависит эта величина? Математическая связь между константой и степенью ионизации (вывод и формулировка закона Оствальда). Вычислите значения константы ионизации Кв и рКв в 1,5% растворе гидроксиламина (NH2OH), если r = 1 г/мл, a = 0,015%.
125. Особенности растворов сильных электролитов (суть теории Дебая и Хюккеля). Понятие об активной концентрации и коэффициенте активности. Математическая зависимость между активной и аналитической (общей) концентрациями. Водный раствор сульфата меди с массовой долей 1% назначают в малых дозах для улучшения кроветворящей функции. Вычислите активность ионов меди в таком растворе
(пл. 1,009 г/мл).
126. Протолитическая теория кислот и оснований. Типы протолитических реакций. Чем являются следующие молекулы и ионы в водных растворах: СН3СООН; СН3СОО–; НСО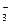 ;
;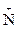 Н3–СН2–СО
Н3–СН2–СО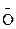 . Ответ подтвердите следующими уравнениями реакций.
. Ответ подтвердите следующими уравнениями реакций.
127. Диссоциация воды. Ионное произведение воды. Определите концентрацию гидроксид-ионов в крови человека при 37оС и 40оС, если рК(Н2О) при 37оС равно 13,61; рК(Н2О) при 40оС равно 13,54, а рН крови считать 7,36.
128. Водородный показатель как характеристика кислотности биологических сред и водных растворов. Рассчитайте рН раствора с с(HCl) = 0,0004 моль/л.
129. Диапазон изменений концентрации протона 1*10–7 – 1,6*10–8 моль/л отвечает совместимым с жизнью состоянием. Каковы пределы значений рН, отвечающие этому состоянию? Дайте определение водородному показателю, как характеристике кислотности биосред.
130. Венозная кровь имеет рН = 7,36, а артериальная – 7,42. Во сколько раз концентрация ионов водорода в венозной крови больше, чем в артериальной?
131. При отравлениях цианидами внутривенно вводят 2% водный раствор нитрата натрия (пл. 1,011 г/мл). Вычислите активности ионов в этом растворе. Что такое активность, коэффициент активности ионов, ионная сила растворов?
132. рК синильной кислоты 9,1. Определите степень ионизации ее в 0,001М растворе. Дайте определение понятиям степень и константа ионизации. Закон разведения Оствальда.
133. Напишите в молекулярном и ионном видах уравнения ступенчатого гидролиза карбоната натрия. Вычислите константу гидролиза, степень гидролиза и рН 0,1М растворов Na2CO3 и NaHCO3. Почему Na2CO3 нельзя использовать в качестве антацидного средства?
134. Вычислите рН 0,1М раствора Na3PO4, если константа гидролиза равна 2,4*10–2. Напишите в молекулярном и ионном видах уравнения гидролиза соли по всем ступеням.
135. Напишите уравнения совместного гидролиза в молекулярном и ионном видах:
а) CuSO4 + Na2CO3 + H2O ®; б) AlCl3 + Na2S + H2O ®. Рассчитайте степень гидролиза в 0,1М растворе LiBrO, если Ка(НBrO) = 2,06*10–9.
136. Сравните степени гидролиза приведенных ниже солей. Укажите, не производя вычислений, рН какого из растворов двух солей одинаковой концентрации выше: а) FeSO4 и Fe2(SO4)3; б) НСООNa и HCOONH4. Каким образом можно подавить гидролиз соли FeCl3?
137. Какие из перечисленных солей подвергаются гидролизу: Mg(NO3)2; КNO3; NH4NO2; CuSO4? Напишите в молекулярном и ионном видах уравнения гидролиза солей. Оцените значение рН.
138. Рассчитайте степень гидролиза, константу гидролиза в растворе NH4Cl, если с(NH4Cl) = 0,08 М, Кв(NH4OH) = 1,75*10–5. Как можно увеличить степень гидролиза хлорида аммония?
139. Какие из перечисленных солей подвергаются гидролизу: Cu(NO3)2; NaNO3; NH4NO2; NiSO4? Напишите в молекулярном и ионном видах уравнения гидролиза солей. Оцените значение рН.
140. Рассчитайте степень гидролиза, константу гидролиза в растворе NH4Cl, если с(NH4Cl) = 0,01М, Кв(NH4ОН) = 1,75*10–5. Как можно увеличить степень гидролиза хлорида аммония?
141. Какие из перечисленных солей подвергаются гидролизу: CaCl2; NaBr; Zn(NO3)2; Na3PO4? Напишите в молекулярном и ионном видах уравнения гидролиза солей. Оцените значение рН. Как можно увеличить степень гидролиза?
142. Вычислите степень гидролиза и рН раствора, полученного при растворении 5,35 г хлорида аммония в 1 л воды (объем раствора принять равным объему воды). От каких факторов зависит степень гидролиза?
143. Напишите уравнения совместного гидролиза в молекулярном и ионном видах: а) CuSO4 + Na2CO3 + H2O ®; б) CrCl3 + Na2S + H2O ®. Как влияет температура на гидролиз солей? Ответ поясните.
144. Какая из солей в большей степени подвергается гидролизу: ацетат натрия или цианид натрия? Константа диссоциации уксусной кислоты 1,77*10–5, а синильной кислоты 4,9*10–10. Как влияет концентрация раствора соли на ее гидролиз?
145. Гидролиз с точки зрения протолитической теории кислот и оснований, приведите примеры. Напишите молекулярные уравнения, отвечающие приведенным ионным реакциям, укажите сопряженные пары:
а) CN– + H2O Û HCN + OH–; б) S2– + H2O Û HS– + OH–;
в) CO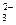 + H2O Û HCO
+ H2O Û HCO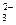 + OH–
+ OH–
146. Какие из перечисленных ниже солей подвергаются гидролизу: NaNO3, K2CO3, K2SO4, KCN? Составьте молекулярные и ионные уравнения гидролиза. Укажите, какую реакцию среды будут иметь их растворы. Ответ поясните.
147. Какую реакцию обнаруживают раcтворы солей: Fe2(SO4)3; Al(NO3)3; NH4NO3? Ответ поясните. Напишите соответствующие молекулярные и ионные уравнения реакций гидролиза.
148. Рассчитайте степень гидролиза натрий ацетата в 0,1М растворе. Используйте табличные данные констант.
149. Рассчитайте степень гидролиза и рН 0,1М раствора натрий карбоната.
150. Вычислите константу гидролиза аммоний хлорида, определите степень гидролиза и значения рН в растворе этой соли с концентрацией 0,01 моль/л.
151. Вычислите степень гидролиза, константу гидролиза и рН 0,1М раствора ацетата калия?
152. Вычислите константу гидролиза фторида калия, определите степень гидролиза этой соли в 0,01М растворе и рН раствора.
153. Вычислите константу гидролиза хлорида аммония, определите степень гидролиза этой соли в 0,01М растворе и рН раствора.
154. Сравните степень гидролиза соли и рН среды в 0,1М и 0,001М растворах цианида калия.
155. Определите степень гидролиза и рН среды 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
156. Гетерогенные равновесия. Константа растворимости. Растворимость Mg(OH)2 в воде равна 1,8*10–4 моль/л. Вычислите Ks(Mg(OH)2). Предложите способ осаждения Mg(OH)2 из насыщенного раствора.
157. Влияние одноименных и разноименных ионов на растворимость. Приведите примеры. Что произойдет с осадком сульфата кальция (Ks(CaSO4) = 2,5*10–5), если в его насыщенный раствор добавить раствор карбоната натрия? Приведите соответствующую схему.
158. В какой последовательности должны выпадать осадки, если к раствору, содержащему ионы Ca2+, Ва2+, Sr2+, постепенно приливать раствор, содержащий сульфат натрия.
159. Напишите выражение константы растворимости и выведите формулу для расчета растворимости малорастворимого электролита AgCl. Выпадет ли осадок хлорида серебра, если к 500 мл 0,001 н. раствора HCl добавить 450 мл 0,0001 н. раствора AgNO3?
160. Напишите выражение константы растворимости и выведите формулу для расчета растворимости малорасторимого электролита СаSO4. В насыщенном растворе объемом 1 мл содержится 0,408 мг CaSO4. Рассчитайте Ks(CaSO4).
161. Константы растворимости AgBrO3 и Ag2SO4 равны соответственно 5,5*10–5 и 2*10–5. Укажите правильное соотношение между растворимостями (S, моль/л) этих солей:
а) s(AgBrO3) < s(Ag2SO4); б) s(AgBrO3)» s(Ag2SO4);
в) s(AgBrO3) > s(Ag2SO4). Ответ подтвердите расчетами.
162. Константы растворимости NiC2O4 и Na3AlF6 одинаковы (4*10–10). Какое соотношение между растворимостями (моль/л) этих солей правильное: а) s (NiC2O4) > s(Na2AlF6); б) s(NiC2O4) = s(Na2AlF6);
в) s(NiC2O4) < s(Na2AlF6). Ответ подтвердите расчетами.
163. В какой последовательности будут выпадать осадки, если к раствору, содержащему ионы Cl–, I–, Br– постепенно приливать раствор AgNO3? (Ks(AgCl) = 1,78*10–10; Ks(AgBr) = 5,3*10–13; Ks(AgI) = 8,3*10–17. Ответ поясните Как такой процесс называется?
164. Напишите выражения константы растворимости и выведите формулы для расчеты растворимости малорастворимых электролитов Sb2S3; Fe(OH)2 и Fe(OH)3. Во сколько раз растворимость (в моль/л) Fe(OH)2 в воде больше растворимости Fe(OH)3 при 25оС?
165. В 500 мл воды при 18оС растворяется 0,0166 г Ag2CrO4. Чему равна константа растворимости этой соли?
166. Образуется ли осадок хлорида свинца, если к 0,1М раствору Pb(NO3)2 добавить равный объем 0,4 н. раствора NaCl?
167. Образуется ли осадок хлорида свинеца, если к 0,2М раствору нитрата свинца прибавить равный объем 0,3М раствора натрий хлорида? Решите задачу с пояснениями.
168. Выпадает ли осадок при сливании равных объемов 0,02М раствора ZnCl2 и 0,0002М раствора Na2S? Ответ поясните.
169. Что будет результатом смешивания 100 мл 0,15М раствора литий нитрата и 200 мл 0,06М раствора калий фторида?
170. Растворимость СаСО3 при 35оС равна 6,9×10–5 моль/л. Вычислите произведение растворимости этой соли.
171. Образуется ли осадок сульфата серебра, если к 0,02М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
172. Вычислите растворимость СаСО3 в дистиллированной воде, 0,01М растворе Na2CO3 и 0,01М растворе Са(NO3)2.
173. Вычислите растворимость ВаSO4 в дистиллированной воде, 0,01М растворе ВаCl2 и 0,01М растворе Na2SO4.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2563; Нарушение авторских прав?; Мы поможем в написании вашей работы!