
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции. 174. Закончите уравнение ОВР, подберите коэффициенты ионно-электронным методом, рассчитайте молярные массы эквивалентов окислителя и восстановителя:
|
|
|
|
174. Закончите уравнение ОВР, подберите коэффициенты ионно-электронным методом, рассчитайте молярные массы эквивалентов окислителя и восстановителя:
1) KI + H2O2 + H2SO4 ®
2) КI + KMnO4 + KOH ®
3) K2Cr2O7 + H2О2 + H2SO4 ®
4) CrCl3 + Br2 + KOH ®
5) K2Cr2O7 + HCl ®
6) CrCl3 + Cl2 + NaOH ®
7) Mg + HNO3разб. ®
8) H2O2 + KMnO4 + H2О ®
9) KMnO4 + КNO2 + КОН ® КNO3 + …
10) K2Cr2O7 + H2S + H2O ® Cr(ОН)3 + …
11) KNO2 + KMnO4 + H2O ® КNO3 + …
12) Na[Cr(OH)4] + Cl2 + NaOH ® Na2CrO4 + …
13) CuCl2 + SO3 + + H2O ® CuCl + …
14) KMnO4 + KBr + H2SO4 ® Br2 + …
15) KIO3 + SnSO4 + H2SO4 ® Sn(SO4)2 + I2 + …
16) MnO2 + FeCl2 + HCl® FeCl3 + MnCl2 + …
17) Ca(ClO)2 + Cu + H2SO4 ® CaSO4 + CuCl2 + H2O
18) KMnO4 + MnSO4 + H2O ® MnO2 + H2SO4 + …
19) H2O + KNO3 + Zn + KOH ® NH3 + K2[Zn(OH)4]
175. Обоснуйте возможность протекания следующих реакций в стандартных условиях, используя табличные данные. Подберите коэффициенты ионно-электронным методом:
1) HI + HNO2 = I2 + NO + H2O
2) KMnO4 + H2O2 + H2SO4 = O2 + MnSO4 + K2SO4 + H2O
3) KMnO4 + Na2SO3 + H2SO4 Û
4) KMnO4 + Na2SO3 + H2O Û
5) KMnO4 + Na2SO4 + KOH Û
6) KI + FeCl3 Û I2 + KCl + FeCl2
7) KBr + FeCl3 Û Br2 + KCl + FeCl2
8) FeSO4 + I2 + H2SO4 ® Fe2(SO4)3 + …
9) Fe2+ + Cr2O + H+ ® Cr3+ + Fe3+
+ H+ ® Cr3+ + Fe3+
10) KMnO4 + КNO2 + КОН ® КNO3 + K2MnO4 + …
11) Pb2+ + Cl2 ® PbO2 + 2Cl–
12) Hg + Fe3+ + H+ ® Fe2+ + Hg2+
+ Fe3+ + H+ ® Fe2+ + Hg2+
13) MnO2 + ClO– ® Cl– + MnO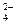
176. Определите, можно ли окислить медь концентрированными и разбавленными растворами азотной кислоты, если jo(Cu2+/Cu) = +0,34 В; jo(NO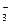 /NO2) = 0,8 В; jo(NO
/NO2) = 0,8 В; jo(NO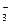 /NO) = +0,96 В? Ответ поясните, напишите уравнения реакций, укажите протекающие на электроде процессы, рассчитайте значение ЭДС. Какой из возможных процессов протекает более интенсивно?
/NO) = +0,96 В? Ответ поясните, напишите уравнения реакций, укажите протекающие на электроде процессы, рассчитайте значение ЭДС. Какой из возможных процессов протекает более интенсивно?
177. Определите, в каком направлении могут самопроизвольно протекать реакции. Ответ поясните. Рассчитайте значение ЭДС:
1) FeCl3 + KI Û FeCl2 + KCl + I2, если jo(Fe3+/Fe2+) = +0,77 В; jo(I2/2I–) = +0,54 В.
2) NaCl + Fe2(SO4)3 Û FeSO4 + Cl2 + Na2SO4, если jo(Fe3+/Fe2+) = +0,77 В; jo(Cl2/2Cl–) = +1,36 В.
3) SnCl2 + FeCl3 Û SnCl4 + FeCl2, если; jo(Sn4+/Sn2+) = +0,15 В. jo(Fe3+/Fe2+) = +0,77 В.
4) 2Mn2+ + 5Br2 + 8H2O ® 2MnO + 10Br– + 16H+, если jo(MnO
+ 10Br– + 16H+, если jo(MnO /Mn2+) = +1,52 В; jo(Br2/2Br–) = +1,06 В
/Mn2+) = +1,52 В; jo(Br2/2Br–) = +1,06 В
5) Mn2+ + NO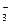 ÛMnO
ÛMnO + NO
+ NO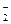 , если jo(NO
, если jo(NO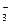 /NO
/NO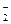 )=+0,83 В; jo(MnO
)=+0,83 В; jo(MnO /Mn2+) = +1,51 В.
/Mn2+) = +1,51 В.
6) КI + FeCl3 Û I2 + FeCl2 + KCl, если jo(I2/2I–) = +0,54 В; jo(Fe3+/Fe2+) = +0,77 В.
7) КF + FeCl3 Û F2 + FeCl2 + KCl, если jo(F2/2F–) = +2,87 В; jo(Fe3+/Fe2+) = +0,77 В.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1058; Нарушение авторских прав?; Мы поможем в написании вашей работы!