
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергетика химических реакций. Физико-термодинамические расчеты. Скорость химических реакций. Химическое равновесие
|
|
|
|
81. Термодинамическая классификация систем, их особенности, основные параметры, системы. Термодинамические процессы.
82. Энергетические характеристики систем и процессов: внутренняя энергия, теплота, работа.
83. I закон термодинамики и его применение к изолированным и закрытым системам.
84. Энтальпия системы, стандартная энтальпия образования простых и сложных веществ. Стандартная энтальпия сгорания. Применение этих величин в термохимических расчетах.
85. Энтальпия химической реакции. Закон Гесса и следствия из него.
86. Энтропия системы. Факторы, влияющие на энтропию системы.
87. Энтропия химической реакции. II закон термодинамики для изолированных систем.
88. Энергия Гиббса. Термодинамические критерии самопроизвольного протекания процесса. Общая формулировка II закона термодинамики для любых систем.
89. Энтальпия системы. Стандартная энтальпия образования простых и сложных веществ. Закон Гесса и следствия из него.
90. Скорость химических реакций. Зависимость скорости гомогенных и гетерогенных реакций от концентрации. Закон действующих масс.
91. Химическое равновесие. Влияние температуры, давления, концентрации реагентов и катализаторов на состояние равновесия. Поясните на примерах.
92. Принцип Ле-Шателье. Применение этого принципа к обратимым системам (поясните на конкретных примерах).
93. Закон действующих масс для обратимых процессов. Связь значения Кравн с изменением энергии Гиббса обратимого процесса. Напишите выражение Кравн следующих процессов:
а) гомогенных 2Н2(г) + О2(г) Û 2Н2О
б) гетерогенных СО2(г) + С(тв) Û 2СО(г)
в) диссоциации в растворе
СН3СООН Û СН3СОО– + Н+; NH4OH Û NH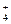 + OH–
+ OH–
[Cu(NH3)4]2+ Û Cu2+ + 4NH3
г) реакции в растворе: СН3СОО– + Н2О Û СН3СООН + OH–
94. Особенности ферментативного катализа.
95. Простые и сложные реакции. Понятие о молекулярности и порядке реакции. Примеры.
96. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации. Особенности для биохимических процессов.
97. Приведите кинетическую классификацию реакций: а) по агрегатному состоянию; б) по обратимости; в) по механизму; г) по числу молекул, участвующих в элементарном акте реакции. Приведите примеры.
98. Теплоты растворения SrCl2 и SrCl2*10H2O составляют соответственно 47,7 и 31 кДж/моль. Вычислите изменение энтальпии реакции:
SrCl2 + 10H2O = SrCl2*10H2O?
99. Реакция протекает по уравнению: 4Аг+ВгÛ2Сг+2Дг+Q. В какую сторону сместится равновесие этой реакции, если давление увеличить в 3 раза и одновременно повысить температуру на 20°? Температурные коэффициенты прямой и обратной реакций соответственно равны 2 и 3.
100. Вычислите стандартную энергию Гиббса биохимической реакции гликолиза: С6Н12О6(aq) ® 2С3Н6О3(aq).
101. Вычислите тепловой эффект реакции при стандартных условиях, используя стандартные теплоты сгорания веществ::
С6Н12О6(aq) ® 2С2Н5ОН(ж) + 2СО2(г)
102. При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий-192. Рассчитайте, какая часть введенного радионуклида останется в опухоли через 20 суток?
103. Рассчитайте энергию, которая выделится при усвоении порции трески массой 356 г, если в 100 г трески в среднем содержится 11,6 г белка и 0,35 г жиров. Калорийность белков 17,1 кДж/г, жиров 38,8 кДж/г.
104. Напишите кинетические уравнения для реакций:
а) СО(г) + О2(г) ® СО2(г); б) Н2(г) + S(тв) ® H2S(г);
в) N2(г) + H2(г) ® NH3(г); г) Fе2О3 + H2 ® Fe + H2O;
д) С12Н22О11 + Н2О Û С6Н12О6 + С6Н12О6.
105. Константа скорости некоторой реакции при 20°С равна 0,03, а при
50°С – 0,4. Вычислите энергию активации.
106. Рассчитайте тепловой эффект реакции по стандартным теплотам образования: С2Н2 + 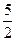 О2 = 2СО2 + Н2О; DН
О2 = 2СО2 + Н2О; DН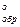 (СО2) = –393,5 кДж/моль; DН
(СО2) = –393,5 кДж/моль; DН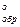 (С2Н2) = +226,8 кДж/моль; DН
(С2Н2) = +226,8 кДж/моль; DН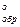 (Н2О) = –285,5 кДж/моль.
(Н2О) = –285,5 кДж/моль.
107. Разложение угольной кислоты при 310 К без катализатора Еа =
96 кДж/моль, а в присутствии карбоангидразы Еа = 54 кДж/моль. Оцените, во сколько раз возрастет скорость реакции при использовании катализатора.
108. Определите порядок и молекулярность для следующих реакций:
а) Н2 + Cl2 = 2HCl; б) СаСО3 = СаО + СО2;
в) С12Н22О11 + Н2О = 2С6Н12О6. Объясните, как определяются порядок и молекулярность для простых и сложных реакций.
109. В каком направлении будет смещаться равновесие в реакции:
СН4 + Н2О Û СО + 3Н2 при уменьшении объема в 3 раза. Ответ дайте на основании расчетов и с использованием принципа Ле-Шателье.
110. Пользуясь табличными значениями DНо и So, вычислите DG для реакций:
а) С(тв) + О2 = СО2; б) Na(тв) + 1/2Cl2 = NaCl(тв).
111. В каком направлении сместится равновесие при повышении давления и температуры систем:
а) СОCl2 Û CO + Cl2; DНо = 113 кДж/моль
б) 2СО Û СО2 + С; DНо = –171 кДж/моль
в) 2SO3 Û 2SO2 + O2; DНо = 192 кДж/моль
112. Константа скорости распада пенициллина при 36оС равна 6*10–6 сек–1, а при 41оС – 1,2*10–5 сек–1. Вычислите температурный коэффициент реакции. Как влияет температура на скорость химической реакции? Ответ поясните.
113. В начальный момент протекания реакции N2 + 3H2 Û 2NH3 концентрации были равны (моль/л): С(N2) = 1,5; C(H2) = 2,5; C(NH3) = 0. Каковы концентрации азота и водорода при концентрации аммиака
0,5 моль/л?
114. Вычислите изменение DSо в реакциях:
а) H2S + Cl2 = 2HCl + S(т)
б) SO3(г) = SO2(г) + 1/2О2
в) Н2О(ж) + О3 Û Н2О2(ж) + О2
г) СН4 + 3СО2 Û 4СО + 2Н2О(г)
115. Вычислите DGо следующих реакций и определите, в каком направлении они будут протекать (все вещества взяты в стандартных условиях):
а) 2N2O + O2 Û 4NO; б) N2O + NO Û NO2 + N2;
в) 4HCl + O2 Û 2Cl2 + 2H2O(г); г) СаСО3 Û СаО + СО2
116. Рассчитайте константы равновесия для реакций: а) 2СО + О2 Û СО2 (при 25оС); б) СОCl2 Û CO + Cl2 (при 100оС).
117. Теплоты растворения и гидратации CuSO4 составляют соответственно –88,2 и –99,8 кДж/моль. Вычислите теплоту растворения CuSO4*5H2O.
118. Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 70оС, если температурный коэффициент реакции равен трем?
119. При 80оС некоторая реакция заканчивается за 16 мин. Сколько потребуется времени для проведения той же реакции: а) при 120оС; б) при 60оС (g= 2).
120. Равновесие реакции Н2 + I2 Û 2НI установилось при следующих концентрациях: [H2] = 0,5 моль/л; [I2] = 0,15 моль/л; [HI] = 1,75 моль/л. Определите исходные концентрации иода, водорода и константу химического равновесия.
121. В какую сторону сместится равновесие реакций:
СОCl2 Û CO + Cl2; DНо = 113 кДж/моль
2СО Û СО2 + С; DНо = –171 кДж/моль
2SO3 Û 2SO2 + O2; DНо = 192 кДж/моль
а) при понижении температуры; б) при повышении давления? Ответ поясните.
122. При равновесии системы N2 + 3H2 Û 2NH3 концентрации [N2] =
1,5 моль/л; [H2] = 4,5 моль/л; [NH3] = 2 моль/л. Вычислите: а) исходные концентрации водорода и азота; б) константу химического равновесия.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 750; Нарушение авторских прав?; Мы поможем в написании вашей работы!