
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виды гибридизации и соответствующие им структуры комплексов
|
|
|
|
| Гибридизация | Структура | Ионы |
| sp | линейная | Ag+, Hg+2 |
| sp3 | тетраэдрическая | Al+3, Zn+2, Co+2, Ti+3, Fe+2 |
| sp2d | плоская квадратная | Pt+2, Pd+2, Cu+2, Ni+2, Au+3 |
| sp3d2 | октаэдрическая | Cr+3, Co+3, Ni+2, Pd+4, Pt+4 |
Электронное строение частиц определяет их магнитные свойства: если все электроны спарены, то их магнитные моменты взаимно компенсируются и суммарный магнитный момент равен нулю, частица диамагнитна и слабо выталкивается из магнитного поля.
Если частица содержит неспаренные электроны, то суммарный магнитный момент отличен от нуля, частица парамагнитна и втягивается в магнитное поле.
Пример. Определите тип гибридизации атомных орбиталей иона Ni+2 и пространственное строение комплексных ионов: а) [NiCl4]2+;
б) [Ni(NH3)6]2+; в) [Ni(CN)4]2–.
Решение:
Электронная конфигурация иона Ni+2 …4so3d8
а) Ионы Ni+2 слабо взаимодействуют с анионами Cl–, поэтому электронные пары лигандов поступают на орбитали внешнего электронного слоя
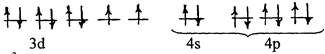
sp3–гибридизация (внешняя), тетраэдрическое строение, парамагнитна.
б) [Ni(NH3)6]2+
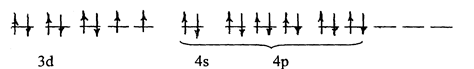
p3d2–гибридизация (внешняя), октаэдрическое строение, парамагнитна.
в) [Ni(CN)4]2–
Ион Ni+2 сильно взаимодействует с ионами CN–. В этом случае происходит спаривание двух d-электронов иона Ni+2 и образовавшаяся свободная ячейка заполняется электронной парой CN–
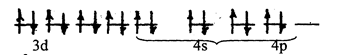
dsp2–гибридизация (внутренняя), плоское квадратное строение, диамагнитна.
б) Теория кристаллического поля
Эта теория основана на предположении об электростатическом взаимодействии между комплексообразователем и лигандами. В свободном атоме или ионе все d-электроны, принадлежащие одной и той же электронной оболочке, обладают одинаковой энергией. Если же ион (атом) попадает в создаваемое лигандами несимметричное поле, то энергия d-электронов будет возрастать тем значительнее, чем ближе к лиганду будет расположена соответствующая орбиталь.
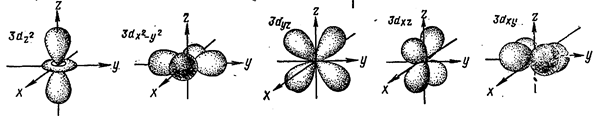
Очевидно, что в октаэдрическом окружении наиболее сильному воздействию поля лигандов будут подвергаться орбитали  и
и  , (dg), следовательно, занимающие эти орбитали электроны будут обладать наибольшей энергией. Напротив, электроны, находящиеся на орбиталях
, (dg), следовательно, занимающие эти орбитали электроны будут обладать наибольшей энергией. Напротив, электроны, находящиеся на орбиталях 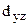 ,
,  и
и 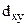 , обладают меньшей энергией. В тетраэдрическом окружении иона лигандами более высокой энергией обладают электроны на орбиталях
, обладают меньшей энергией. В тетраэдрическом окружении иона лигандами более высокой энергией обладают электроны на орбиталях 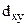 ,
, 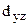 и
и  (
(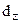 ). Таким образом, происходит расщепление энергетических уровней, величина энергии расщепления (D) зависит от природы лигандов и конфигурации комплекса.
). Таким образом, происходит расщепление энергетических уровней, величина энергии расщепления (D) зависит от природы лигандов и конфигурации комплекса.

В порядке убывания энергии расщепления лиганды располагаются в следующий спектрохимический ряд:
CN– > 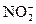 > этилендиамин > NH3 > NCS– > H2O > F– > COO– > OH– > Cl– > Br– > I–
> этилендиамин > NH3 > NCS– > H2O > F– > COO– > OH– > Cl– > Br– > I–
Лиганды слабого поля вызывают малое расщепление энергии
d-подуровня, поэтому энергия отталкивания двух спаренных электронов превышает энергию расщепления. Заполнение электронами d-орбиталей осуществляется в этом случае в соответствии с правилом Хунда. Лиганды сильного поля вызывают значительное расщепление d -подуровня, при этом энергия расщепления превышает энергию межэлектронного отталкивания спаренных электронов, поэтому в первую очередь заполняются нижние d-орбитали в соответствии с принципом Паули.
Пример. Объясните, почему ион [FeF6]4– парамагнитен, а ион [Fe(CN)6]4– – диамагнитен.
Решение:
Электронное строение иона Fe+2 …4so3d6
В октаэдрическом поле лигандов происходит расщепление
d-подуровня. Но для лигандов слабого поля (F–) D < Еоттал. е , а для лигандов сильного поля D > Еоттал. е .
В связи с этим распределение электронов можно выразить следующими схемами:


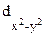 (dg)
(dg) 
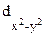 (dg)
(dg)
dxy dxz dyz (de) dxy dxz dyz (de)
[FeF6]4– [Fe(CN)6]4–
Как следует из схемы, [FeF6]4– содержит неспаренные электроны, следовательно, он парамагнитен, а комплекс [Fe(CN)6]4– – диамагнитен, так как не содержит неспаренных электронов.
При наличии на подуровне dg вакантных орбиталей возможен переход электрона с de на
dg-подуровень. Поглощаемая им при этом энергия равна энергии расщепления
D = NA×E= NA×h×n = NA×h×c/l, где
NA – число Авогадро;
h – постоянная Планка;
с – скорость света;
n и l – соответственно частота и длина волны поглощаемого света.
Таким образом, спектр поглощения и окраска большинства комплексов d-элементов обусловлена переходами электронов с de на dg-орбиталь. Если комплексообразователь имеет конфигурацию благородных газов, например, Cu+, Ag+, Zn+2, Cd+2, Hg+2 и др., то такие комплексы бесцветны по причине невозможности перехода электронов.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 4079; Нарушение авторских прав?; Мы поможем в написании вашей работы!