
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные процессы
|
|
|
|
11.1. Общая характеристика окислителей и восстановителей.
Окислительно-восстановительные реакции – эта реакции, протекающие с изменением степеней окисления одного или нескольких элементов, входящих в состав реагирующих веществ.
По окислительно-восстановительной способности различают:
а) окислители; б) восстановители; в) вещества, обладающие окислительно-восстановительной двойственностью.
а) Окислителями могут быть:
1) простые вещества: F2, O3;
2) вещества, содержащие в своем составе атомы элементов в высших степенях окисления: 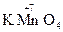 ,
, 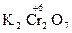 ,
, 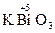 ,
, 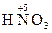 ,
, 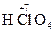 ,
, 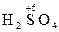 ,
, 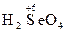 ,
, 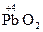 и др.
и др.
б) Восстановителями могут быть:
1) металлы;
2) вещества, содержащие в своем составе атомы элементов в низших степенях окисления: H–, S2–, Hal–, N–3.
в) Окислительно-восстановительной двойственностью обладают:
1) простые вещества, атомы которых могут как отдавать, так и принимать электроны: H2, Hal2, S, N, C, Si, P и др.
2) катионы металлов в промежуточной степени окисления: Cu+, Fe+2, Cr+3, Mn+4, Pb+2 и др.
3) анионы и молекулы, содержащие элементы в промежуточных степенях окисления: 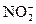 , NO2, NO,
, NO2, NO, 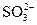 ,
, 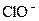 ,
, 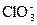 ,
, 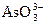 , SO2, NH2OH, N2H4 и др.
, SO2, NH2OH, N2H4 и др.
11.2. Составление уравнений реакций окисления-восстановления
При подборе коэффициентов в ОВР используют два метода:
а) метод электронного баланса;
б) ионно-электронный метод (метод полуреакций).
а) Метод электронного баланса применяют для подбора коэффициентов в ОВР, протекающих в газовой, твердой фазах, расплавах, безводных средах.
б) Ионно-электронный метод применяют для подбора коэффициентов в ОВР, протекающих в водных растворах.
Если в ОВР кислородсодержащее соединение теряет атомы кислорода, то в кислой среде они связываются протонами, а в нейтральной и водной средах – молекулами воды согласно схемам:
2Н+ + О2– ® Н2О; Н2О + О2– ® 2ОН–
Если в ОВР соединение приобретает атомы кислорода, то в кислой и нейтральной средах используется молекулы воды, а в щелочной – анионы гидроксила согласно схемам:
Н2О ® О2– + 2Н+; 2ОН– ® О2– + Н2О.
Пример: Ионно-электронным методом подобрать коэффициенты в ОВР:
а) NaNO2 + KMnO4 + H2SO4 ® NaNO3 + MnSO4 + K2SO4 + H2O;
б) NaNO2 + KMnO4 + H2O ® NaNO3 + MnO2 + KOH
в) MnSO4 + KClO3 + KOH ® K2MnO4 + KCl + K2SO4 + H2O.
Решение:
а) NaNO2 + KMnO4 + H2SO4 ® NaNO3 + MnSO4 + K2SO4 + H2O
1) Определяем окислитель и восстановитель по изменению степеней окисления атомов элементов (NaNO2, KMnO4).
2) Напишем ионные уравнения полуреакций для процессов окисления и восстановления: малорастворимые и слабые электролиты, газообразные вещества пишем в молекулярной форме, включаем частицы, характеризующие среду (H+, H2O, OH–), при этом производим подсчет зарядов левой и правой частей уравнений и за счет добавления или вычитания электронов в левой части полуреакции уравниваем заряды обеих частей уравнения.
3) Определяем множители для полуреакций таким образом, чтобы число электронов, принимаемых окислителем, было равно числу электронов, отдаваемых восстановителем.
4) Переносим множители в уравнения полуреакций, складываем левые и правые части уравнений, сокращаем одинаковые частицы в обеих частях уравнения.


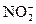 + Н2О – 2е ®
+ Н2О – 2е ® 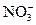 + 2Н+ 5
+ 2Н+ 5
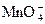 + 8Н+ + 5е ® Mn2+ + 4H2O 10 2
+ 8Н+ + 5е ® Mn2+ + 4H2O 10 2
 5
5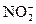 + 5Н2О + 2
+ 5Н2О + 2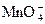 + 16Н+ ® 5
+ 16Н+ ® 5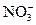 + 10Н+ + 2Mn2+ + 8H2O
+ 10Н+ + 2Mn2+ + 8H2O
Напишем итоговое ионное уравнение ОВР:
5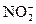 + 2
+ 2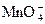 + 6Н+ ® 5
+ 6Н+ ® 5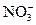 + 2Mn2+ + 3H2O
+ 2Mn2+ + 3H2O
5) Переносим коэффициенты итогового уравнения в молекулярное уравнение:
5NaNO2 + 2KMnO4 + 3H2SO4 ® 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
б) NaNO2 + KMnO4 + H2O ® NaNO3 + MnO2 + KOH
Подбираем коэффициенты согласно алгоритму, изложенному в примере (а)


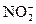 + Н2О – 2е ®
+ Н2О – 2е ® 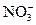 + 2Н+ 3
+ 2Н+ 3

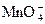 + 2Н2О + 3е ® MnО2 + 4OН– 2
+ 2Н2О + 3е ® MnО2 + 4OН– 2
3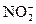 + 3Н2О + 2
+ 3Н2О + 2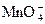 + 4Н2О ® 3
+ 4Н2О ® 3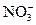 + 6Н+ + 2MnО2 + 8OН–
+ 6Н+ + 2MnО2 + 8OН–
Учитывая, что 6Н+ + 8ОН– ® 6Н2О + 2ОН–, сокращаем одинаковые частицы в обеих частях уравнения, составляем итоговое ионное уравнение и переносим коэффициенты в молекулярное уравнение
3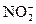 + 2
+ 2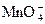 + Н2О ® 3
+ Н2О ® 3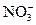 + 2MnО2 + 2OН–
+ 2MnО2 + 2OН–
3NaNO2 + 2KMnO4 + H2O ® 3NaNO3 + 2MnO2 + 2KOH
(Примечание: полуреакции для этой ОВР можно составить также с учетом щелочного характера среды).
в) MnSO4 + KClO3 + KOH ® K2MnO4 + KCl + K2SO4 + H2O

 Mn+2 + 8OH– – 4 e ®
Mn+2 + 8OH– – 4 e ® 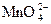 + 4H2O 3
+ 4H2O 3

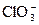 + 3H2O + 6 e ® Cl– + 6OH– 2
+ 3H2O + 6 e ® Cl– + 6OH– 2
3Mn+2 + 24OH– + 2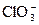 + 6H2O ® 3
+ 6H2O ® 3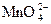 + 12H2O + 2Cl– + 12OH–
+ 12H2O + 2Cl– + 12OH–
3Mn+2 + 2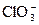 + 12OH–® 3
+ 12OH–® 3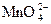 + 2Cl– +6H2O
+ 2Cl– +6H2O
3MnSO4 + 2KClO3 + 12KOH ® 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
11.3. Особые случаи составления уравнений ОВР.
а) Окислитель (восстановитель) расходуется дополнительно на связывание продуктов восстановления (окисления).
Пример:
Ва + HNO3 ® Ba(NO3)2 + NH4NO3 + H2O

 Ba – 2 e ® Ba+2 4
Ba – 2 e ® Ba+2 4
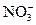 + 10H+ + 8 e ®
+ 10H+ + 8 e ® 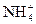 + 3H2O 8 1
+ 3H2O 8 1
 4Ba +
4Ba + 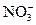 + 10H+ ® 4Ba+2 +
+ 10H+ ® 4Ba+2 + 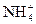 + 3H2O
+ 3H2O
Всего в уравнении реакции участвует 10 молекул HNO3, из которых 1 молекула HNO3 окисляет барий, а 9 молекул HNO3 связывают ионы бария
4Ва + HNO3 + 9HNO3 ® 4Ba(NO3)2 + NH4NO3 + 3H2O
окислитель солебразователь
б) В окислительно-восстановительном процессе изменяют степень окисления 3 атома элемента, причем восстановителями (окислителями) являются одновременно оба атома, входящие в состав одного и того же вещества.
Пример:
As2S3 + HNO3 ® H3AsO4 + H2SO4 + NO2 + H2O
 As2S3 + 20H2O – 28 e ® 2H3AsO4 +
As2S3 + 20H2O – 28 e ® 2H3AsO4 + 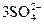 + 34H+ 1
+ 34H+ 1

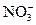 + 2H+ + e ® NO2 + H2O 28
+ 2H+ + e ® NO2 + H2O 28
As2S3 + 28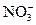 + 20H2O + 56H+ ® 2H3AsO4 +
+ 20H2O + 56H+ ® 2H3AsO4 + 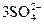 + 34H+ + 28NO2 + 28H2O
+ 34H+ + 28NO2 + 28H2O
As2S3 + 28HNO3 ® 2H3AsO4 + 3H2SO4 + 28NO2 + 8H2O
11.4. Направление окислительно-восстановительных процессов
В ОВР участвуют сопряженные пары: окислитель и его восстановленная форма, восстановитель и его окисленная форма. Окислителем в ОВР является окисленная форма окислительно-восстановительной пары с более электроположительным значением потенциала, а восстановителем – восстановленная форма окислительно-восстановительной пары с более электроотрицательным значением потенциала. ОВР будет протекать в том направлении, для которого разность потенциалов окислителя и восстановителя будет величиной положительной.
Пример: Определите направление протекания реакции в стандартных условиях
PbO2 + KI + H2SO4 = I2 + K2SO4 + PbSO4 + H2O
Решение:
1) Для определения окислителя и восстановителя выпишем табличные значения стандартных потенциалов окислительно-восстановительных пар: jо(PbO2/Pb+2) = 1,68 В, jо(I2/2I–) = 0,53 В. Так как
|jо(PbO2/Pb+2)| > |jо(I2/2I–)|, то окислителем будет PbO2, а восстановителем I–.
2) Запишем процессы восстановления и окисления

 PbO2 + 4H+ + 2 e ® Pb+2 + 2H2O 1 восстановление
PbO2 + 4H+ + 2 e ® Pb+2 + 2H2O 1 восстановление
2I– – 2 e ® I2 1 окисление
PbO2 + 4H+ + 2I– ® Pb+2 + I2 + 2H2O
3) Рассчитаем разность потенциалов Djо = jоокислителя – jовосстановителя =
1,68 – 0,53=1,15 В > 0.
Таким образом, Djо > 0, следовательно реакция идет в прямом направлении:
PbO2 + 2KI + 2H2SO4 ® I2 + K2SO4 + PbSO4 + 2H2O
Пример: Можно ли окислить ионы Fe+2 молекулами: а) Cl2: б) I2?
Решение:
а) Fe+2 + Cl2 = Fe+3 + 2Cl–
б) Fe+2 + I2 = Fe+3 + 2I–
Выпишем табличные данные: jо(Fe+3/Fe+2) = 0,77 В; jо(Cl2/2Cl–) =
+1,36 В; jо(I2/2I–) = 0,53 В. Так как Fe+2 должен выполнять роль восстановителя, а галогены – роль окислителя, то реакция будет идти, если Djо > 0, то есть |jо(Hal2/2Hal–)| > |jо(Fe+3/Fe+2)|. Это условие соблюдается для реакции с Cl2, следовательно, Cl2 будет окислять Fe+2, а I2 – не будет.
Пример: Какие окислительно-восстановительные свойства проявляет Н2О2 при взаимодействии с: а) K2Cr2O7; б) KBr – в кислой среде.
Решение:
Так как K2Cr2O7 может быть только окислителем, то нужно определить, сможет ли Н2О2 восстановить K2Cr2O7. Окисленной формой Н2О2 будет О2.
jо(О2/Н2О2) = +0,68 В; jо(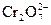 /2Cr+3) = +1,33 В.
/2Cr+3) = +1,33 В.
Djо = jо(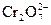 /2Cr+3) – jо(О2/Н2О2) = 1,33 – 0,68 = 0,65 В. Таким образом Djо > 0, следовательно, реакция осуществима.
/2Cr+3) – jо(О2/Н2О2) = 1,33 – 0,68 = 0,65 В. Таким образом Djо > 0, следовательно, реакция осуществима.
б) KBr может быть только восстановителем, поэтому нужно определить, сможет ли Н2О2 окислить Br –. Восстановленной формой Н2О2 является Н2О.
jо(Н2О2/Н2О) = +1,78 В; jо(Br2/2Br–) = +1,08 В.
Djо = jо(Н2О2/Н2О) – jо(Br2/2Br–) = 1,78 – 1,08 = 0,7 В. Таким образом, Djо > 0, следовательно, реакция осуществима.
Пример: Определите, какой из металлов – магний или никель – интенсивнее взаимодействует с разбавленной серной кислотой.
Решение:
Mg + H2SO4 ® MgSO4 + H2 (1)
Ni + H2SO4 ® NiSO4 + H2 (2)
jо(Mg+2/Mg) = –2,363 В; jо(Ni+2/Ni) = –0,25 В; jо(2H+/H2) = 0,00 В
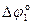 = jо(2H+/H2) – jо(Mg+2/Mg) = 0 – (–2,363) = 2,363 В.
= jо(2H+/H2) – jо(Mg+2/Mg) = 0 – (–2,363) = 2,363 В.
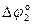 = jо(2H+/H2) – jо(Ni+2/Ni) = 0 – (–0,25) = 0,25 В.
= jо(2H+/H2) – jо(Ni+2/Ni) = 0 – (–0,25) = 0,25 В.
Таким образом, Mg будет взаимодействовать с H2SO4 более интенсивно, чем Ni.
11.5. Количественные расчеты в ОВР.
В основе количественных расчетов лежит закон эквивалентов. Эквивалент окислителя или восстановителя – это частица, эквивалентная одному принятому или отданному электрону.
Пример: Какую массу FeSO4 можно восстановить в кислой среде 15,8 г KMnO4?
Решение:
10FeSO4 + 2KMnO4 + 8H2SO4 ® 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
 2Fe+2 – 2 e ® 2Fe+3 5
2Fe+2 – 2 e ® 2Fe+3 5
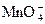 + 8H+ + 5 e ® Mn+2 + 4H2O 2
+ 8H+ + 5 e ® Mn+2 + 4H2O 2
 |
10Fe+2 + 2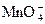 + 16H+® 10Fe+3 + 2Mn+2 + 8H2O
+ 16H+® 10Fe+3 + 2Mn+2 + 8H2O
fэк(FeSO4) = 1; fэк(KMnO4) = 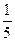
Согласно закону эквивалентов: n(FeSO4) = n(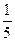 KMnO4)
KMnO4)
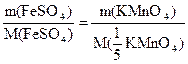
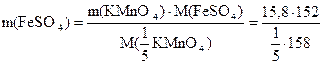 = 76 г
= 76 г
Пример: Рассчитайте объем 1 н. раствора K2Cr2O7, вступающего в реакцию с 400 мл 0,5 н. раствора KNO2 в кислой среде.
Решение:
3KNO2 + K2Cr2O7 + 4H2SO4 ® 3KNO3 + Cr2(SO4)3 + K2SO4 + 7H2O

 + Н2О – 2 е ®
+ Н2О – 2 е ® 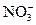 + 2Н+ 3
+ 2Н+ 3
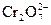 + 14Н+ + 6 е ® 2Cr+3 + 7H2O 1
+ 14Н+ + 6 е ® 2Cr+3 + 7H2O 1

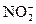 + 3Н2О +
+ 3Н2О + 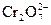 + 14Н+ ® 3
+ 14Н+ ® 3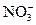 + 6Н+ + 2Cr+3 + 7H2O
+ 6Н+ + 2Cr+3 + 7H2O
fэк(KNO2) =  ; fэк(K2Cr2O7) =
; fэк(K2Cr2O7) = 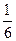
n( KNO2) = n(
KNO2) = n(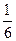 K2Cr2O7)
K2Cr2O7)
c( KNO2)×Vp(KNO2) = c(
KNO2)×Vp(KNO2) = c(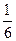 K2Cr2O7)×Vp(K2Cr2O7)
K2Cr2O7)×Vp(K2Cr2O7)
Vp(K2Cr2O7) = 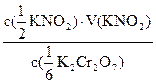
Vp(K2Cr2O7) = 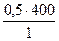 = 200 мл
= 200 мл
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1970; Нарушение авторских прав?; Мы поможем в написании вашей работы!