
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление ОВР
|
|
|
|
Количественной характеристикой окислительно-восстановительных процессов являются нормальные окислительно-восстановительные потенциалы окислителей и восстановителей или стандартные потенциалы электродов.
При 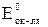 > >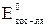 окислительно-восстановительная реакция возможна, и наоборот.
Величины стандартных окислительно-восстановительных потенциалов приведены в Приложении Л. окислительно-восстановительная реакция возможна, и наоборот.
Величины стандартных окислительно-восстановительных потенциалов приведены в Приложении Л.
|
Например:
Возьмем реакцию, в результате которой железо окисляется до
железа (II):
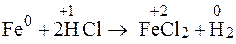
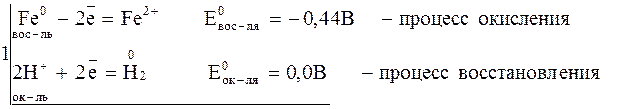 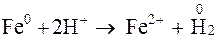 Так как
Так как 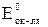 > >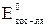 , реакция возможна.
Рассмотрим возможность окисления железа до железа (III): , реакция возможна.
Рассмотрим возможность окисления железа до железа (III):
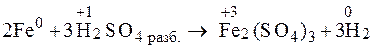
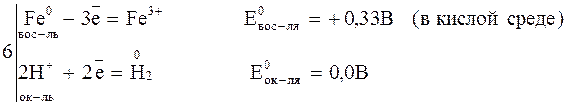 Так как
Так как 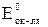 < < 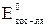 , реакция невозможна.
2Fe + 3H2SO4 разб ≠ Fe2(SO4)3 + 3H2
Вывод: неокислительной кислотой Fe0 окисляется только до Fe2+. , реакция невозможна.
2Fe + 3H2SO4 разб ≠ Fe2(SO4)3 + 3H2
Вывод: неокислительной кислотой Fe0 окисляется только до Fe2+.
|
4.3. Гальванический элемент Даниэля-Якоби
При погружении металла в раствор собственных ионов начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной является реакция поверхностных ион-атомов металла, находящихся в узлах решетки, с полярными молекулами воды, ориентированными у поверхности электрода.
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла.
На границе металл–раствор возникает двойной электрический слой. Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода.
Гальванический элемент Даниэля-Якоби (рис.4.3) состоит из медной пластины, погруженной в раствор CuSО4, и цинковой пластины, погруженной в раствор ZnSО4.
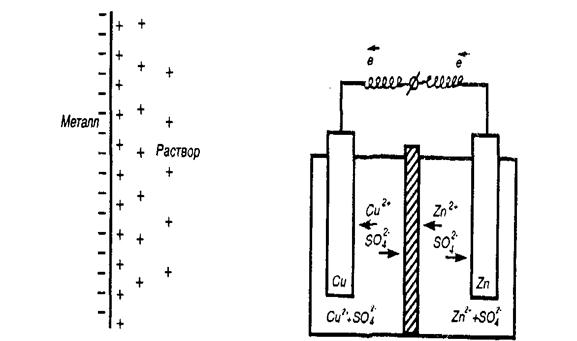 Рис.4.3. Двойной электрический Схема гальванического
слой на границе раздела элемента Даниэля-Якоби.
металл–раствор.
Рис.4.3. Двойной электрический Схема гальванического
слой на границе раздела элемента Даниэля-Якоби.
металл–раствор.
|
При работе элемента Даниэля – Якоби протекают следующие процессы:
1) реакция окисления цинка Zn0 – 2е → Zn2+
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди Сu2+ + 2е → Сu0
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
3) движение электронов во внешней цепи;
4) движение ионов в растворе: анионов (SO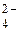 ) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем:
Zn + Cu2+ = Сu + Zn2+.
Суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей. При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1 -го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода – двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде
Zn | Zn2+ || Cu2+ | Сu ) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем:
Zn + Cu2+ = Сu + Zn2+.
Суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей. При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1 -го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода – двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде
Zn | Zn2+ || Cu2+ | Сu
|
4.4. Электродвижущая сила (ЭДС)
| Электрическая работа равна произведению разности потенциалов электродов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС). Она равна разности равновесных потенциалов катода и анода элемента. Максимальная электрическая работа гальванического элемента при превращении одного моля вещества Wэ равна Wэ = nFEэ где Еэ – ЭДС гальванического элемента, n – число молей эквивалентов в одном моле вещества. ЭДС элемента равна разности равновесных потенциалов положительного электрода (в элементе катода) и отрицательного электрода в элементе анода). Если потенциал одного из электродов принять равным нулю, то относительный потенциал второго электрода будет равен ЭДС элемента. Таким образом, можно определить относительный потенциал любого электрода. |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 407; Нарушение авторских прав?; Мы поможем в написании вашей работы!