
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение солей
|
|
|
|
| нормальных или средних |
| При взаимодействии: 1) металла с неметаллом Fe + S = FeS; 2) кислоты с металлом Zn + H2SO4 = ZnSO4 + Н2↑; 3) кислоты с основанием HCl + NaOH = NaCl + Н2О; 4) кислоты с основным оксидом 2 HCl + СuО = CuCl2 +Н2О; 5) кислотного оксида с основным оксидом SO3 + СuО = СuSO4; 6) кислотного оксида с основанием СO2 + Ca(ОН)2 = СаСО3 + Н2О; 7) кислоты с солью H2SO4 + BaCl2 = BaSO4↓ + 2 HCl; 8) щелочи с солью 2 NaOH + CuSО4 = Сu(ОН)2 ↓ +Na2SО4; 9) двух солей АgNО3 + NaCl = AgCl ↓ + NaNО3; 10) соли с металлом CuSO4 + Fe = FeSО4 + Сu↓. |
| основных |
| Только многокислотные основания дают основные соли. l) кислоты с избытком основания: HCl + Мg(ОН)2 = MgOHCl + Н2О; 2) нормальной соли с недостаточным количеством основания: Вi(NО3)3 + 2 NaOH = Вi(ОН)2NО3 + 2 NaNО3; CаCl2 + КОН = СаОНСl + KCl. |
| кислых |
| Только многоосновные кислоты дают кислые соли. l) при взаимодействии основания с избытком кислоты: NaOH + H2SО4 = NaНSO4 + Н2О; 2) при действии на нормальную соль избытка той же кислоты: ↓СаСО3 + СО2 + Н2О = Са(НСО3)2. |
| получение нормальных солей из кислых |
| При действии основания на кислую соль получаются нормальные соли: 2 СаНРО4 + Са(ОН)2 = Са3(РО4)2 + 2 Н2О. |
| получение нормальных солей из основных |
| Нормальные соли из основных получаются при действии кислоты на основную соль: MgOHCl + НСl = MgC12 + Н2О; FеОН(NО3)2 + НNО3 = Fе(NО3)3 + Н2O. |
2.5. Комплексные соединения
| Комплексные соединения – определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии. | |||
| Комплексообразователь (центральный атом) –один из атомов, обычно положительно заряженный, занимающий центральное место в молекуле комплексного соединения. | |||
| Лиганды – противоположно заряженные ионы или нейтральные молекулы, расположенные вокруг комплексообразователя. | |||
| Координационное число центрального иона – общее число σ-связей, образуемых комплексообразователем с лигандами. | |||
| внутренняя сфера ион-комплексообразователь + лиганды = комплексный ион | внешняя сфера противоионы (катион или анион соли) | ||
Например: [Cu(NH3)4]Cl2 – хлорид тетраамин меди (II)
Образование комплексных соединений связано со способностью катионов металлов присоединять определенные молекулы и/или отрицательно заряженные ионы. Cu2++4NH3 = [Cu(NH3)4]2+ [Cu(NH3)4]2+ + 2Cl– = [Cu(NH3)4]Cl2 [ ] – комплексный ион – донорно-акцепторная связь, Cu2+ – комплексообразователь, NH3 – лиганды, 4 – координационное число (к/ч) [Cu(NH3)m]. Заряд комплексного иона равен алгебраической сумме зарядов иона-комплексообразователя и лигандов. |
| Ион | К/ч | Ион | К/ч |
| Al3+ | 4,6 | Ag+ | |
| Zn2+ | Hg+ | ||
| Fe2+ | 4,6 | Hg2+ | |
| Fe3+ | 4,6 | Cr3+ | 4,6 |
| Комплексные соединения могут относиться к различным классам: солям, основаниям, кислотам. Комплексные ионы могут быть как положительными, так и отрицательными, т.е. выступать в соединениях в виде катионов и в виде анионов, например: Na[Аu(CN)2] = Na+ + [Аu(CN)2]–; К2[HgI4] = 2К+ + [HgI4]2–; [Сu(NН3)4]SO4 = [Сu(NН3)4]2+ + SO42–. |
| Получение комплексных соединений |
| Один из способов получения комплексных соединений основан на введении в химическую систему избытка лигандов для создания соотношения, соответствующего координационному числу. На этом принципе основаны реакции растворения некоторых осадков, в т.ч. амфотерных гидроксидов в растворах щелочей. а) Zn(OH)2(осадок)+2KOH = K2[Zn(OH)4] Zn(OH)2+2OH– = [Zn(OH)4]2–; б) AlCl3+3KOH =↓Al(OH)3+3KCl Al(OH)3+KOH = K[Al(OH)4] или Al(OH)3+3KOH = K3[Al(OH)6] Al(OH)3 + 3ОН– = [Al(OH)6]3–; в) HgI2(осадок)+2KI = K2[HgI4] – тетрайодогидроаргат(II) калия HgI2+2I– = [HgI4]2–. |
| Другой из способов – взаимодействие металлов с водными растворами щелочей. Металлы, оксиды которых обладают амфотерными свойствами, взаимодействуют с водными растворами щелочей, образуя гидроксокомплексы. В этих реакциях окислителем является вода, из которой восстанавливается водород: Zn + 2H2O + 2KOH → K2[Zn(OH)4] + H2↑. |
| Химические свойства комплексных соединений |
| Комплексным соединениям присущи многие свойства обычных соединений. Например, реакции обмена с участием двух солей: 3FeCl2+2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+6KCl; 3Fe2++2[Fe(CN)6]3– = Fe3[Fe(CN)6]2. |
| Для комплексных соединений характерны специфические реакции, связанные с замещением одного лиганда другим. [Cu(H2O)4]SO4+4NH3=[Cu(NH3)4]SO4+4H2O; [Cu(H2O)4]2++4NH3=[Cu(NH3)4]2+ + 4H2O. Координационное число комплексного иона возрастает с увеличением силы лиганда. CN– > NO2– > NH3 > CNS– > H2O > OH– > CL– > Br– > I–. Лиганды, расположенные в левой части называют сильными, в правой – слабыми (относительно середины). |
В водных растворах комплексные соединения диссоциируют на комплексные ионы и ионы внешней сферы;
[Сu(NН3)4]C12 ↔ [Сu(NН3)4]2+ + 2Cl–.
Ионы внешней сферы присоединены к комплексному иону ионной связью. В незначительной степени комплексный ион тоже может диссоциировать:[Сu(NН3)4]2+ ↔ Сu2++ 4NН3.
Константа равновесия данной системы определяет прочность комплексного иона и называется константа нестойкости:
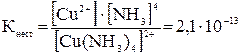 Чем больше Кнест, тем менее прочен комплексный ион.
Чем больше Кнест, тем менее прочен комплексный ион.
|
| Номенклатура комплексных соединений |
| В названии комплексных соединений отражается его состав справа налево, в названии комплексного иона (то, что в […]) последовательно перечисляется число лигандов, название лиганда, название иона-комплексообразователя, причем, для аниона используются латинская основа слова, а для катиона – русская. |
| Например: [Cu(NH3)4]2+ – ион тетрааминмеди (II); NH3 – амин; CN– – циано; [Ag(NH3)2]+ – ион диамин серебра; [Al(H2O)6]3+ – ион гексааква алюминия; [Al(OH)4]– – тетрагидроксоалюминат; [Cu(NH3)4](OH)2 – гидроксидтетраамин меди (II); H2[TiCl6] – гексахлортитановая кислота. |
Раздел 3. Растворы
| Растворы – это системы, состоящие из двух и более компонентов, состав и количество которых можно изменять в определенных пределах без нарушения однородности. Вещество, которое не меняет агрегатное состояние при растворении и содержится в большем количестве, называется растворителем. |
| Истинными растворами называют однородную (гомогенную) смесь вещества, в которой компоненты находятся в виде молекул или ионов. Размеры частиц не превышают 1 нм. Такой раствор устойчив долго. Например: воздух, смесь газов – это газообразный раствор; морская вода – это жидкий раствор различных солей в воде; большинство сплавов металлов являются твердыми растворами. |
| Совокупность химических взаимодействий между растворителем и растворенным веществом при образовании растворов называется сольватацией (гидратацией для водных растворов), а образующиеся химические соединения называются сольватами (гидратами для водных растворов). Если раствор находится в равновесии с избытком растворенного вещества, то образуется насыщенный раствор. Растворимость или коэффициент растворимости вещества – это максимальное количество вещества в граммах, растворенного в 100 г растворителя при данной температуре. Если вещество еще может растворяться в данном растворе, то он называется ненасыщенным. Мерой растворимости в данных условиях служит содержание его в насыщенном растворе. Растворимость данного вещества определяется концентрацией его насыщенного раствора. Сведения о растворимости различных веществ в воде при температуре 25 °С помещены в Приложении Г. Растворимость веществ определяется двумя факторами: 1) природой вещества и его агрегатным состоянием; 2) внешними условиями (температура, давление, изменение концентрации веществ и т.д.). Процесс растворения сопровождается тепловым эффектом ± ∆H. |
3.1. Способы выражения концентрации растворов
Массовая доля (процентная концентрация) ω – это отношение массы компонента m(x) к массе всего раствора mр-ра.
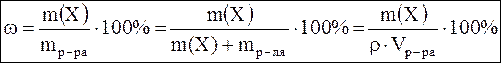 ,
где m р-ля – масса растворителя, г;
ρ – плотность раствора, г/см3;
V – объем раствора, л. ,
где m р-ля – масса растворителя, г;
ρ – плотность раствора, г/см3;
V – объем раствора, л.
|
Молярная концентрация вещества (молярность) С(х) – это отношение количества вещества n(x), содержащегося в системе, к объему V этой системы.
 ,
где m – масса растворенного вещества, г;
М – молярная масса вещества, г/моль;
V – объем рабочего раствора, л.
Единица измерения: моль/л, моль/дм3, моль/м3.
Допускается обозначение М.
Различают одномолярные (1М), двумолярные (2М), децимолярные (0,1М) и сантимолярные(0,01М) растворы.
Например, 1М HCl – одномолярный раствор HCl, т.е. С(HCl)=1моль/л. ,
где m – масса растворенного вещества, г;
М – молярная масса вещества, г/моль;
V – объем рабочего раствора, л.
Единица измерения: моль/л, моль/дм3, моль/м3.
Допускается обозначение М.
Различают одномолярные (1М), двумолярные (2М), децимолярные (0,1М) и сантимолярные(0,01М) растворы.
Например, 1М HCl – одномолярный раствор HCl, т.е. С(HCl)=1моль/л.
|
Молярная концентрация эквивалентов (нормальность) С(fэквХ) – это отношение количества вещества эквивалентов растворенного вещества n(fэквХ) к объему раствора V.
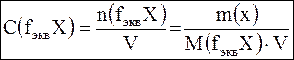 ,
Единица измерения: моль/л.
Допускается обозначение н.
Например, 0, 1н NaOH – децинормальный раствор NaOH, т.е.
С( ,
Единица измерения: моль/л.
Допускается обозначение н.
Например, 0, 1н NaOH – децинормальный раствор NaOH, т.е.
С( NaOH) = 0,1 моль/л. NaOH) = 0,1 моль/л.
|
Моляльная концентрация (моляльность) Cm(x) – это количество растворенного вещества 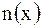 в 1 кг растворителя. в 1 кг растворителя.
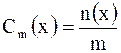 моль/кг,
где моль/кг,
где 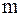 – масса растворителя, кг. – масса растворителя, кг.
|
Мольная доля 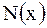 вещества – это отношение количества вещества компонента к общему количеству вещества системы. Для бинарного раствора вещества – это отношение количества вещества компонента к общему количеству вещества системы. Для бинарного раствора 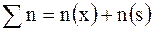 ,
где ,
где 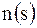 – количество вещества растворителя, – количество вещества растворителя,
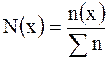
|
Титр раствора Т(х) – это масса вещества 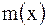 , содержащаяся в 1 см , содержащаяся в 1 см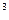 раствора: раствора: 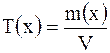 , г/ см , г/ см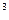
|
3.2. Растворы неэлектролитов
| Неэлектролиты– это вещества (большинство органических веществ), молекулы которых при растворении на ионы не распадаются. |
| Свойства разбавленных растворов неэлектролитов |
| Давление пара над жидкостью. В результате естественного испарения над жидкостью образуется пар, давление которого можно измерить с помощью манометра. Процесс испарения – это эндотермический процесс (∆Н>0). Одновременно с этим процессом протекает обратный процесс – экзотермический процесс конденсации (∆Н<0). При определенных условиях устанавливается равновесие, которое определяется равенством скоростей испарения и конденсации. Равновесное состояние при данной температуре характеризуется давлением насыщенного пара. |
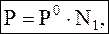 Давление пара над раствором. Определяется первым законом Рауля (при растворении некоторого количества нелетучего вещества):
где P – давление насыщенного пара над раствором,
N1 – мольная доля растворителя в растворе.
Если чистый растворитель (N1 = 1), то P = P0 (давление насыщенного пара чистого растворителя). Если раствор, то N1 < 1, тогда P < P0. Отсюда, давление насыщенного пара над раствором всегда меньше, чем над чистым растворителем. Давление пара над раствором. Определяется первым законом Рауля (при растворении некоторого количества нелетучего вещества):
где P – давление насыщенного пара над раствором,
N1 – мольная доля растворителя в растворе.
Если чистый растворитель (N1 = 1), то P = P0 (давление насыщенного пара чистого растворителя). Если раствор, то N1 < 1, тогда P < P0. Отсюда, давление насыщенного пара над раствором всегда меньше, чем над чистым растворителем.
|
| Температура кипения жидкости. Это температура, при которой давление насыщенного пара над жидкостью равно внешнему давлению. |
Температура кипения раствора. Мы знаем, что давление насыщенного пара растворителя над раствором меньше, чем давление насыщенного пара над чистым растворителем. Значит, чтобы давление насыщенного пара стало равным внешнему давлению (условие закипания жидкости), раствор нужно нагреть до более высокой температуры, чем чистый растворитель. Таким образом, температура кипения раствора (Т2) выше температуры кипения чистого растворителя (Т1) на величину 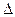 t: t:
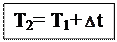 Повышение температуры кипения определяется по второму закону Рауля:повышение температуры кипения раствора прямопропорционально моляльной концентрации растворенного вещества, а именно: Повышение температуры кипения определяется по второму закону Рауля:повышение температуры кипения раствора прямопропорционально моляльной концентрации растворенного вещества, а именно:
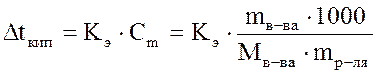 ,
где mв-ва– масса растворенного вещества (г),
Mв-ва– молярная масса растворенного вещества (г/моль),
mр-ля– масса растворителя,
Кэ– эбулиоскопическая константа (0С), которая равна повышению температуры кипения раствора при растворении 1 моль вещества в 1 кг растворителя. Величина Кэ зависит от природы растворителя. Для воды Кэ=0,52 0С∙моль-1. Эбулиоскопические константы некоторых растворителей приведены в Приложении Д. ,
где mв-ва– масса растворенного вещества (г),
Mв-ва– молярная масса растворенного вещества (г/моль),
mр-ля– масса растворителя,
Кэ– эбулиоскопическая константа (0С), которая равна повышению температуры кипения раствора при растворении 1 моль вещества в 1 кг растворителя. Величина Кэ зависит от природы растворителя. Для воды Кэ=0,52 0С∙моль-1. Эбулиоскопические константы некоторых растворителей приведены в Приложении Д.
|
| Температура замерзания жидкости. Это температура, при которой давление насыщенного пара над жидкостью равно давлению насыщенного пара кристаллов жидкости (Ркр(ж) = Рж). |
Температура замерзания раствора. Если в равновесную систему лёд–вода (Ркр(тв)=Рж) ввести растворимое вещество, например сахар, то равновесие нарушится, поскольку образовался раствор и давление насыщенного пара понизится. Это нарушение связано с конденсацией избытка паров, протекающей с выделением тепла. Чтобы восстановить равновесное состояние, необходимо в соответствии с принципом Ле-Шателье понизить температуру на величину 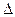 t. Следовательно, температура замерзания раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Согласно второму закону Рауля: понижение температуры замерзания раствора прямопропорционально моляльной концентрации растворенного вещества, а именно: t. Следовательно, температура замерзания раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Согласно второму закону Рауля: понижение температуры замерзания раствора прямопропорционально моляльной концентрации растворенного вещества, а именно:
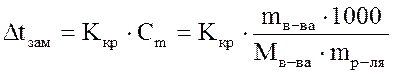 ,
где Ккр– криоскопическая константа (0С), которая численно равна понижению температуры замерзания при растворении 1 моль вещества в 1 кг растворителя. Величина Ккр зависит от природы растворителя. Для воды Ккр=1,86 0С∙моль-1. Криоскопические константы некоторых растворителей приведены в Приложении Д. ,
где Ккр– криоскопическая константа (0С), которая численно равна понижению температуры замерзания при растворении 1 моль вещества в 1 кг растворителя. Величина Ккр зависит от природы растворителя. Для воды Ккр=1,86 0С∙моль-1. Криоскопические константы некоторых растворителей приведены в Приложении Д.
|
Осмос – это самопроизвольный переход молекул растворителя в раствор через полупроницаемую перегородку (мембрану). Полупроницаемая мембрана представляет собой тонкую плёнку, проницаемую для молекул растворителя и непроницаемую для молекул растворенного вещества.
В общем случае, если концентрация растворенного вещества в растворе А больше, чем в растворе В, то возникает самопроизвольно поток молекул растворителя из раствора В в раствор А через мембрану (идет самопроизвольный процесс выравнивания концентраций). Этот процесс можно прекратить, если повысить давление в растворе А.
Разность давлений, при которой прекращается переход растворителя в раствор, называется осмотическим давлением (Росм), которое определяется по уравнению Вант-Гоффа:
 ,
где n – количество растворенного вещества (моль),
V – объем раствора (л),
Т – температура (К),
R – универсальная газовая постоянная.
Если давление определять в атмосферах, то ,
где n – количество растворенного вещества (моль),
V – объем раствора (л),
Т – температура (К),
R – универсальная газовая постоянная.
Если давление определять в атмосферах, то 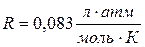 ,
если в мм. рт. ст., то ,
если в мм. рт. ст., то 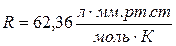 . .
|
Законы Рауля и Вант -Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Поэтому для описания свойств растворов использовать все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. Активность а связана с концентрацией со следующим соотношением:
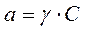 ,
где γ – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора. ,
где γ – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора.
|
3.3. Растворы электролитов. Электролитическая диссоциация
| Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электролитический ток. Молекулы электролита при растворении распадаются на ионы – положительные (катионы) и отрицательные (анионы). Процесс распада веществ на ионы получил название электролитической диссоциации. В общем виде: КА ↔ К+ + А–. |
| Свойства растворов электролитов Основные положения теории электролитической диссоциации |
1. Электролиты в растворе диссоциируют на ионы. Ионы в растворе устойчивы и по свойствам резко отличаются от их атомов.
NaCl = Na+ + Cl–
Na+ – не имеет ни запаха, ни вкуса.
2Na + 2H2O → 2NaOH + H2↑
Cl– – безвреден;
Cl2 – отравляющее вещество.
Различают ионы:
– простые, состоят из атомов одного элемента:
Na+, Cl–, H+, Fe 2+, Cu2+
– сложные, состоят из атомов двух и более элементов:
OH–, SO , SO , SO , NH , NH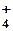 Некоторые ионы окрашены: MnO
Некоторые ионы окрашены: MnO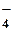 – фиолетовый, Cu2+ – голубой, Fe3+ – бурый.
2. Ионы в растворе перемещаются хаотично, «странствуют». Если в раствор электролита опустить электроды и подать напряжения, то пойдет электрический ток, значит, ионы получили направленное движение: катионы – к катоду (–), анионы – к аноду (+).
3. Наряду с процессом диссоциации в растворе электролита идет процесс ассоциации, т.е образование молекул из ионов. – фиолетовый, Cu2+ – голубой, Fe3+ – бурый.
2. Ионы в растворе перемещаются хаотично, «странствуют». Если в раствор электролита опустить электроды и подать напряжения, то пойдет электрический ток, значит, ионы получили направленное движение: катионы – к катоду (–), анионы – к аноду (+).
3. Наряду с процессом диссоциации в растворе электролита идет процесс ассоциации, т.е образование молекул из ионов.
|
| Количественно процесс диссоциации электролитов характеризуется: степенью диссоциации – α, константой диссоциации – К д, изотоническим коэффициентом – i. |
Согласно теории Аррениуса, диссоциация электролитов – процесс обратимый, поэтому в растворах электролитов наблюдается равновесие между ионами и недиссоциированными молекулами. Отношение количества вещества молекул электролита, распавшихся на ионы (n1, моль), к его первоначальному (исходному) количеству (n0, моль) называется степенью диссоциации (α):
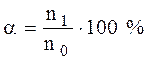 .
Если степень диссоциации электролита при его концентрации 0,1 моль/л превышает 30%, то электролиты называются сильными. Для слабых электролитов α < 3%. Все остальные являются электролитами средней силы.
Слабые электролиты – это вещества, диссоциация которых в растворе протекает обратимо и устанавливается равновесие:
КА ↔ К+ + А–
Равновесие устанавливается между той частью молекул, которые продиссоциировали (правая часть уравнения) и той частью молекул, которые находятся в растворенном, недиссоциированном состоянии (левая часть уравнения).
Сильные электролиты – это вещества, согласно электролитической теории электролитов (П. Дебай),диссоциирующие в растворе полностью, например: .
Если степень диссоциации электролита при его концентрации 0,1 моль/л превышает 30%, то электролиты называются сильными. Для слабых электролитов α < 3%. Все остальные являются электролитами средней силы.
Слабые электролиты – это вещества, диссоциация которых в растворе протекает обратимо и устанавливается равновесие:
КА ↔ К+ + А–
Равновесие устанавливается между той частью молекул, которые продиссоциировали (правая часть уравнения) и той частью молекул, которые находятся в растворенном, недиссоциированном состоянии (левая часть уравнения).
Сильные электролиты – это вещества, согласно электролитической теории электролитов (П. Дебай),диссоциирующие в растворе полностью, например:
| ||
| гидроксиды | NaOH=Na++OH– Ca(OH)2=Ca2++2OH– | |
| кислоты | HCl = H+ + Cl–
H2SO4 = 2H+ + SO
| |
| соли | средние | NaCl = Na+ + Cl–
Fe2(SO4)3= 2Fe3+ + 3SO
|
| кислые | NaHSO4 = Na+ + HSO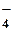 Сa(HCO3)2 = Ca2+ + 2HCO
Сa(HCO3)2 = Ca2+ + 2HCO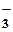
| |
| основные | AlOHCl2 = AlOH2+ + 2Cl–(Al(OH)2)2SO4 =2Al(OH)2+ + SO
|
Константа электролитической диссоциации КД– это константа химического равновесия в растворе электролита.
Для реакции типа КА = К+ + А– константа равновесия равна:
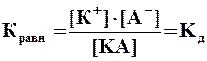 где [К+], [А–], [КA] – концентрации ионов и молекул вещества.
Существует математическая связь между степенью диссоциации и константой диссоциации:
где [К+], [А–], [КA] – концентрации ионов и молекул вещества.
Существует математическая связь между степенью диссоциации и константой диссоциации: 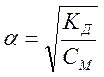 , , 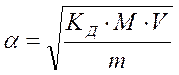 ,
где V – объем раствора,
М – молярная масса вещества,
m – масса вещества,
CМ – молярная концентрация вещества.
Эта формула справедлива, если ,
где V – объем раствора,
М – молярная масса вещества,
m – масса вещества,
CМ – молярная концентрация вещества.
Эта формула справедлива, если 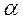 слабого электролита мала.
Если в растворе электролита AB степень его диссоциации равна слабого электролита мала.
Если в растворе электролита AB степень его диссоциации равна 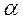 , то концентрация ионов К+ и А–, в растворе одинаковы и составляют:
[К+] = [А–] = α∙СМ
Величина константы диссоциации зависит от природы слабого электролита и растворителя, а также от температуры и не зависит от разбавления системы. , то концентрация ионов К+ и А–, в растворе одинаковы и составляют:
[К+] = [А–] = α∙СМ
Величина константы диссоциации зависит от природы слабого электролита и растворителя, а также от температуры и не зависит от разбавления системы.
|
Изотонический коэффициент – i.Если сравнивать два раствора (электролита и неэлектролита с одинаковой молярной концентрацией), то окажется, что в случае раствора электролита доля связанного растворителя выше и поэтому свойства чистого растворителя и раствора отличаются более резко.
Чтобы примирить эти противоречия, Вант-Гофф ввел коэффициент, названный изотоническим.
Физический смысл изотонического коэффициента: i показывает, во сколько раз увеличилось общее число частиц в растворе в результате происшедшего частичного или полного распада молекул на ионы. Для растворов электролитов:
1) 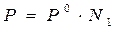 , , 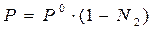 ,
где N1 – молярная доля растворителя;
N2 – молярная доля растворенного вещества. ,
где N1 – молярная доля растворителя;
N2 – молярная доля растворенного вещества.
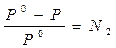 , , 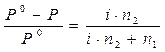 ,
где Р, (Р0) – давление насыщенного пара раствора (растворителя),
n1 – количество вещества растворителя,
n2 – количество вещества растворенного вещества.
2) ,
где Р, (Р0) – давление насыщенного пара раствора (растворителя),
n1 – количество вещества растворителя,
n2 – количество вещества растворенного вещества.
2) 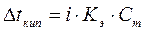 , , 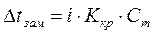 , ,
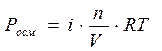 .
Существует математическая связь между степенью диссоциации и изотоническим коэффициентом: .
Существует математическая связь между степенью диссоциации и изотоническим коэффициентом:
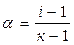 ,
где к– число ионов, образующихся при диссоциации одной молекулы электролита. Например,
для электролита KCl:к = 2,
т.к. в растворе образуются по одному иону калия и хлора (1+1=2);
для Al2(SO4)3: к = 5,
т.к. два иона алюминия и три сульфат-иона(2+3=5);
для Na2SO4: к= 3,
т.к. два иона натрия и один сульфат-ион(2+1=3).
Используя формулу ,
где к– число ионов, образующихся при диссоциации одной молекулы электролита. Например,
для электролита KCl:к = 2,
т.к. в растворе образуются по одному иону калия и хлора (1+1=2);
для Al2(SO4)3: к = 5,
т.к. два иона алюминия и три сульфат-иона(2+3=5);
для Na2SO4: к= 3,
т.к. два иона натрия и один сульфат-ион(2+1=3).
Используя формулу 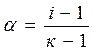 , видим, что
для неэлектролитов , видим, что
для неэлектролитов 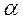 = 0, тогда i = 1,
для электролитов = 0, тогда i = 1,
для электролитов 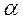 > 0, тогда i > 1. > 0, тогда i > 1.
|
| Водородный и гидроксильный показатели |
Вода является очень слабым электролитом. Диссоциация воды протекает условно по уравнению, где устанавливается равновесие:
Н2О=Н++ОН–
Константа диссоциации воды равна 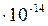 .
Произведение концентраций ионов Н+ и ОН– – величина постоянная, называемая ионным произведением воды.
Сн+ · Сон- = .
Произведение концентраций ионов Н+ и ОН– – величина постоянная, называемая ионным произведением воды.
Сн+ · Сон- =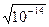 =10–7 моль/л.
Такие растворы называются нейтральными.
Если в растворе Сн+ > Сон-, т.е. Сн+ > 10–7 моль/л, а Сон-<10–7 моль/л, то реакция среды кислая.
Если в растворе Сн+ < Сон-, т.е. Сн+ < 10–7 моль/л, а Сон->10–7 моль/л, то реакция среды щелочная.
Прологарифмируем уравнение ионного произведения воды: =10–7 моль/л.
Такие растворы называются нейтральными.
Если в растворе Сн+ > Сон-, т.е. Сн+ > 10–7 моль/л, а Сон-<10–7 моль/л, то реакция среды кислая.
Если в растворе Сн+ < Сон-, т.е. Сн+ < 10–7 моль/л, а Сон->10–7 моль/л, то реакция среды щелочная.
Прологарифмируем уравнение ионного произведения воды:
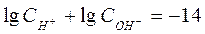 , , 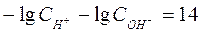 .
Величину .
Величину 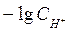 называют водородным показателем рН,
а величину – lgCОН- гидроксильным показателем рОН. называют водородным показателем рН,
а величину – lgCОН- гидроксильным показателем рОН.
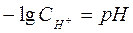 ; ; 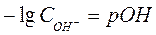 .
Следовательно, рН + рОН = 14.
В нейтральном растворе рН = рОН = 7.
В щелочной среде рН > 7, рОН < 7.
В кислых растворах рН < 7, рОН > 7. .
Следовательно, рН + рОН = 14.
В нейтральном растворе рН = рОН = 7.
В щелочной среде рН > 7, рОН < 7.
В кислых растворах рН < 7, рОН > 7.
|
3.4. Ионно-молекулярные уравнения реакций
| Сущность реакций в растворах электролитов становится очевидной, если их записывать в виде ионно-молекулярных уравнений. Правило составления таких уравнений состоит в следующем: Все малорастворимые, летучие вещества и слабые электролиты записывают в виде молекул, а сильные, легко растворимые – в виде ионов. |
| Не расписываются на ионы: газы, оксиды, нерастворимые соединения (осадки ↓), H2S; NH4OH; CH3COOH; HMnO4. |
Например: Составим ионно-молекулярные уравнения для реакции:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl – молекулярное уравнение.
Ba2+ + 2Cl– + 2Na+ + SO → BaSO4↓ + 2Na+ + 2Cl– – полное ионно-молекулярное уравнение. Если теперь сократить ионы, которые в результате реакции остаются неизменными,
Ba2+ + → BaSO4↓ + 2Na+ + 2Cl– – полное ионно-молекулярное уравнение. Если теперь сократить ионы, которые в результате реакции остаются неизменными,
Ba2+ +  → BaSO4↓ + → BaSO4↓ +  → BaSO4↓. → BaSO4↓.
|
| Произведение растворимости |
Все вещества обладают определенной растворимостью в том или ином растворителе. Абсолютно нерастворимых веществ нет. Пусть имеется сильный электролит КА, то между твердым веществом и его насыщенным раствором установится равновесие:
КА = К+ + А–,
ПР(КА) = [К+] [А–].
Произведение равновесных концентраций ионов в насыщенном растворе малорастворимого сильного электролита при данной температуре есть величина постоянная, называемая произведением растворимости. Если произведение концентраций ионов в растворе превышает величину ПР, то выпадет осадок, если же не достигает величины ПР, то осадок образоваться не может. Численное значение произведения растворимости электролита нетрудно найти, зная его растворимость.
Например, растворимость сульфата кальция при 20 °С равна 1,5∙10–2 моль/л. Это значит, что в насыщенном растворе концентрация каждого из ионов Ca2+ и SO равна 1,5∙10–2 моль/л. Следовательно, произведение растворимости этой соли:
ПР(СaSO4) = [Ca2+]∙[SO равна 1,5∙10–2 моль/л. Следовательно, произведение растворимости этой соли:
ПР(СaSO4) = [Ca2+]∙[SO ] = (1,5∙10–2)2 = 2,25·10-4.
Таблица произведений растворимости в Приложении Е. ] = (1,5∙10–2)2 = 2,25·10-4.
Таблица произведений растворимости в Приложении Е.
|
3.5. Гидролиз
| Гидролизом соли называется взаимодействие слабых ионов соли с водой, в результате, которого образуется молекула или ион слабого электролита и изменяется реакция среды. |
| Соли, в состав которых входит катион сильного основания и анион слабой кислоты, при гидролизе создают щелочную среду (рН > 7), так как в результате гидролиза получается слабая кислота или анион кислой соли. Например: К2СО3 + Н2О ↔ КОН + КНСО3, СО32- + НОН ↔ ОH- + НСО3-, рН > 7 |
| Соли, в состав которых входит катион слабого основания и анион сильной кислоты при гидролизе, создают кислую среду (рН < 7) вследствие образования слабого основания или катиона основной соли. Например: CuC12 + Н2О ↔ CuOHCl + HCl, Сu2++ НОН ↔ CuOH+ +Н+. рН <7 |
| Соли, образованные слабыми основаниями и слабыми кислотами, подвергаются полному гидролизу, если слабые ионы однозарядные, так как в результате образуются два слабых электролита. Например: СН3СООNН4 + Н2О → СН3СООН + NН4ОH, СН3СОО- + NH4+ + НОН → СН3СООН + NH4ОH, рН» 7 В случае, если ионы разнозарядные, то гидролиз протекает следующим образом: (NН4)2S + Н2О → NН4HS + NН4ОH, NH4+ + S2– + НОН → NH4ОH + HS–, рН ³ 7 слабощелочная |
| Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются, так как ни один из ионов не будет связывать молекулы воды с образованием слабого электролита. Например: КNО3 + Н2О ≠. Степень гидролиза (отношение числа гидролизованных молекул к общему числу растворенных молекул) увеличивается при разбавлении раствора и при повышении температуры. |
Раздел 4. Элекрохимические системы
| Электрохимические процессы – процессы взаимного превращения химической и электрической форм энергии. |
| Электрохимические процессы можно разделить на две основные группы: 1) Процессы превращения химической энергии в электрическую (в гальванических элементах); 2) Процессы превращения электрической энергии в химическую (электролиз). |
| Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником. Ионным проводником (проводником 2-го рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость (проводники 1-го рода) и находящиеся в контакте с ионным проводником. Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы. Рассмотрим вначале общие закономерности электрохимических процессов, относящиеся как к превращению электрической энергии в химическую, так и к превращению химической энергии в электрическую. К ним относятся законы Фарадея, термодинамика и кинетика электрохимических процессов. |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 896; Нарушение авторских прав?; Мы поможем в написании вашей работы!
