
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы Фарадея
|
|
|
|
| С учетом современной терминологии законы Фарадея можно записать в следующем виде: 1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества; 2) массы прореагировавших на электродах веществ при постоянном, количестве электричества относятся друг к другу как молярные массы их эквивалентов. При превращении одного моля эквивалентов вещества на электроде через него проходит 96484, или округленно 96500 Кл (Ас). Эта величина называется постоянная Фарадея F. Постоянную Фарадея F можно рассчитать, исходя из того, что один моль эквивалентов вещества несет 6,022∙1023 элементарных зарядов (постоянная Авогадро), а элементарный заряд равен 1,602∙10–19 Кл. Отсюда F = 6,0220∙1023 · 1,602∙10–19 = 96484 или –96500 Кл/(моль∙экв). |
4.1. Степень окисления
| Для характеристики состояния элементов в соединениях введено понятие степени окисления. Под степенью окисления (СО) понимается условный заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов. |
| Определение степени окисления проводят при помощи следующих правил: |
1.Степень окисления элемента в простом веществе, например, в металле или в простой молекуле, например, Н2, N2, O3, равна нулю.
2.Элементы, которые имеют постоянную степень окисления:
– элементы I, II-ой групп, главных подгрупп периодической системы Менделеева, соответственно для I: +1, для II: +2,
–фтор F: –1,
– алюминий Al: +3,
– цинк Zn: +2,
– кислород O: –2 (Исключение: 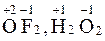 ),
– водород H: +1 (Исключение: гидриды – ),
– водород H: +1 (Исключение: гидриды – 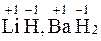 ).
3.В целом молекула электронейтральна. Это значит, что сумма произведений степеней окисления элемента на количество этого элемента в химическом соединении, равна нулю для молекулы или заряду иона в молекулярном ионе, т.е.
количество катионов (+) = количеству анионов (–)
Большинство элементов могут проявлять переменную СО в соединениях. Возможные степени окисления элементов приведены в Приложении Ж.
4.Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона, например,
+ 1 –1 +2 –1 +3 –1 +4 –1
NaI, MgCl2, AlF3, ZrBr4.
5. Заряд кислотного остатка всегда отрицателен и равен числу атомов H в молекуле кислоты:
HNO3 → NO3‾, H2SO4 → SO42– , H3PO4 → PO43–. ).
3.В целом молекула электронейтральна. Это значит, что сумма произведений степеней окисления элемента на количество этого элемента в химическом соединении, равна нулю для молекулы или заряду иона в молекулярном ионе, т.е.
количество катионов (+) = количеству анионов (–)
Большинство элементов могут проявлять переменную СО в соединениях. Возможные степени окисления элементов приведены в Приложении Ж.
4.Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона, например,
+ 1 –1 +2 –1 +3 –1 +4 –1
NaI, MgCl2, AlF3, ZrBr4.
5. Заряд кислотного остатка всегда отрицателен и равен числу атомов H в молекуле кислоты:
HNO3 → NO3‾, H2SO4 → SO42– , H3PO4 → PO43–.
|
Например, рассчитаем степень окисления атома азота в соединениях KNО2 и HNО3. Степень окисления водорода и щелочных металлов в соединениях равна +1, а степень окисления кислорода –2. Соответственно, степень окисления азота равна:
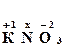 → 1 + x + 3∙(–2) = 0,
x = +5 → → 1 + x + 3∙(–2) = 0,
x = +5 → 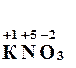 Аналогичным способом можно определить степень окисления элементов в любых соединениях.
Аналогичным способом можно определить степень окисления элементов в любых соединениях.
|
4.2. Окислительно-восстановительные реакции (ОВР)
| Реакции, в результате которых изменяются степени окисления двух и более элементов, называются окислительно-восстановительными. | |
| Восстановитель | Окислитель |
| Вещество, в состав которого входит элемент, отдающий электроны (увеличивающий степень окисления, СО↑). | Вещество, в состав которого входит элемент, принимающий электроны (уменьшающий степень окисления, СО↓). |
ОВР – два взаимно противоположных процесса. Каждый элемент имеет высшую окисленную форму ВОФ и низшую восстановленную форму НВФ.
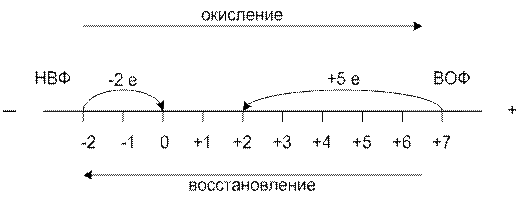
| +ē – окислитель, принимает ē, СО↓, – процесс восстановления; –ē – восстановитель, отдает ē, СО↑, – процесс окисления. |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 433; Нарушение авторских прав?; Мы поможем в написании вашей работы!