
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Нахождение коэффициентов при уравнивании ОВР
|
|
|
|
Существует два способа уравнивания ОВР
1. метод электронного баланса;
2. метод электронно-ионного баланса (метод полуреакций).
Метод электронного баланса
Уравнивание ОВР основано на том, что число отданных и принятых ē должно быть одинаковым.
Порядок уравнивания ОВР:
1.Находим элементы которые меняют СО;
2.Составляем схему передачи ē;
3.Уравниваем число отданных и принятых ē;
4.Выставляем коэффициент перед окислителем и восстановителем в молекулярном уравнении;
5.Уравниваем элементы которые не меняли СО.
Например:
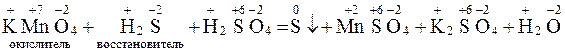

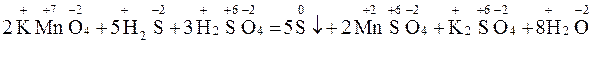
|
Метод электронно-ионного баланса (метод полуреакций)
При составлении уравнений реакций по методу полуреакций (электронно-ионного баланса) необходимо следовать следующим правилам:
1.Соблюдать равенство суммарного числа электронов, отданных восстановителем и принятых окислителем. Электронный баланс сохраняет электронейтральность системы.
2.Сохранить число атомов исходных веществ в продуктах реакций независимо от изменения состава исходного соединения. Этот баланс основан на законе сохранения массы веществ при их химических превращениях.
3.Условно расчленить суммарный химический процесс на частные реакции – окислительную и восстановительную, в которых наряду с молекулами (ионами) участниками превращения являются электроны. Число электронов, отданных одной частицей восстановителя, является коэффициентом при молекуле (ионе) окислителя в суммарном уравнении. Аналогично число электронов, принятых окислителем, является коэффициентом при восстанавливающей частице.
4.Окислительная система – система, имеющая наибольшее значение стандартного электродного потенциала
Аокисл.ф.I + nē ↔ Bвосст.ф.I
Восстановительная система – это система, имеющая меньшее значение стандартного электродного потенциала
Ввосст.ф.II – nē ↔ Аокисл.ф.II
Суммарное уравнение реакции:
Аокисл.ф.I + Ввосст.ф.II ↔ Аокисл.ф.II + Bвосст.ф.I
5.Реакции в водных растворах целесообразно отображать ионно-молекулярными уравнениями, так как обмен электронами осуществляется преимущественно при участии ионов веществ. Малорастворимые, твердые и газообразные вещества и слабо диссоциирующие вещества записываются только в молекулярной форме. Если реакция идет в кислой среде, то продуктами ее являются соли всех металлов данной кислоты и вода.
6.При составлении уравнения реакции с кислородсодержащими анионами (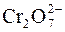 , , 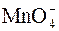 , , 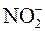 , ,  , , 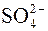 и т.д.) следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов, например: и т.д.) следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов, например:
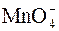 + 8H+ + 5ē ↔ Mn2+ + 4H2O – кислая среда; + 8H+ + 5ē ↔ Mn2+ + 4H2O – кислая среда;
 + 6H2O + 8ē ↔ NH3 + 9OH– – нейтральная и щелочная среда.
Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды, например:
I2 + 6H2O – 10ē ↔ 2 + 6H2O + 8ē ↔ NH3 + 9OH– – нейтральная и щелочная среда.
Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды, например:
I2 + 6H2O – 10ē ↔ 2 + 12H+ – кислая и нейтральная среда; + 12H+ – кислая и нейтральная среда;
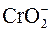 + 4OH– – 3ē ↔ + 4OH– – 3ē ↔ 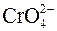 + 2H2O – щелочная среда. + 2H2O – щелочная среда.
|
Например: а) K2Cr2O7 + H3PO3 + H2SO4 → Cr2(SO4)3 + H3PO4 + K2SO4 + H2O,
3 H3PO3 – 2ē + H2O = H3PO4 + 2H+ – процесс окисления Cr2O72– + 14H+ + 3H3PO3 + 3H2O = 3H3PO4+ 6H+ +2Cr3+ + 7H2O, после сокращения H2O и H+, имеем: Cr2O72– + 8H+ + 3H3PO3 = 3H3PO4 + 2Cr3+ + 4H2O, тогда молекулярное уравнение имеет вид: K2Cr2O7+3H3PO3+4H2SO4 = Cr2(SO4)3+3H3PO4+K2SO4+4H2O. K2Cr2O7 – окислитель; H3PO3 – восстановитель
3 SO32– – 2ē + 2ОН- = SO42–+ H2O – процесс окисления 2 MnO4– + 3ē + 2H2O = MnO2 + 4OH– – процесс восстановления 3SO32– + 6ОН– + 2MnO4– + после сокращения H2O и OH–, имеем: 3SO32– + 2MnO4– + H2O = 3SO42– + 2MnO2 + 2OH–, тогда молекулярное уравнение имеет вид: 3Na2SO3 +2 KMnO4 + H2O = 3 Na2SO4 + 2MnO2 + 2KOH. Na2SO3 – восстановитель; KMnO4 – окислитель. При уравнивании реакций методом электронно-ионного баланса (методом полуреакций) записываем две полуреакции – окисления и восстановления, в которых сильные электролиты пишем в виде ионов, а слабые – в виде молекул. Затем каждую полуреакцию уравниваем. Уравнивание полуреакций зависит от среды раствора. Если среда кислая, то для уравнивания используем ионы водорода Н+ и Н2О (добавляем где недостаток кислорода), а если щелочная – то гидроксо-группы ОН– и Н2О (добавляем где избыток кислорода). После этого уравниваем число отданных и принятых электронов, выставляем коэффициенты перед полуреакциями окислителя и восстановителя и записываем суммарное ионно-молекулярное уравнение с учетом выставленных коэффициентов. В полученном уравнении приводим подобные члены и переносим коэффициенты в молекулярное уравнение. |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 512; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 1 Cr2O72– + 6ē + 14H+ = 2Cr3+ + 7H2O – процесс восстановления
1 Cr2O72– + 6ē + 14H+ = 2Cr3+ + 7H2O – процесс восстановления б) Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH,
б) Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH,