
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства гидроксидов
|
|
|
|
Химические свойства оксидов
| основные оксиды |
| – основный оксид + кислота = соль + Н2О CaО + 2 НС1 = СaС12 + Н2О; – основный оксид + кислотный оксид = соль Na2O + СO2 = Na2CO3; – оксиды щелочных и щелочноземельных металлов + Н2О = основный гидроксид Na2O + Н2О = 2 NaOH; CaO + Н2О = Ca (OH)2. |
| кислотные оксиды |
| – кислотный оксид + гидроксид = соль + Н2О CО2 + Ca(OH)2 = Сa СO3 + Н2О; – кислотный оксид + основной оксид = соль SO2 + Na2O = Na2SO3; – кислотный оксид + Н2О = кислота CO2 + Н2О = H2СO3. |
| амфотерные оксиды |
| – амфотерный оксид + кислота = соль + Н2О ZnO + H2SO4 = ZnSO4 + Н2О; – амфотерный оксид + гидроксид = соль + Н2О ZnO + 2 NaOH = Na2ZnO2+ Н2О. |
2.2. Гидроксиды металлов
Гидроксиды –это такие вещества, которые диссоциируют в водных растворах с отщеплением аниона гидроксогруппы ОН–.
Носителем основных свойств является гидроксид-ион ОН–. |
| Получение гидроксидов |
| Растворимые гидроксиды получаются при взаимодействии: –. щелочных и щелочноземельных металлов с водой 2Na + 2Н2О = 2NaOH + Н2; –. оксидов щелочноземельных металлов с водой СаО + Н2О = Са(ОН)2; –. нерастворимые гидроксиды получаются при взаимодействии шелочей с растворимыми солями соответствующих металлов FeCl3 + 3 NaOH = Fe(OH)3 ↓ + 3 NaCl. |
| Основные гидроксиды (основания) | ||||
– основный гидроксид + кислота = соль + Н2О
Fе(ОН)2 + 2НС1 = FеС12 + 2Н2О;
– основный гидроксид + кислотный оксид = соль + Н2О
Са(ОН)2 + SO3 = CaSO4 + Н2О;
– основный гидроксид + соль = другой основный гидроксид + другая соль
2 NaOH + CuSO4 = Cu(OH)2 ↓ + Na2SO4;
– основный гидроксид + основный оксид ≠
NaOH + CuO ≠;
– основный гидроксид + основный гидроксид ≠
Са(ОН)2 + NaOH ≠;
– нерастворимые в воде гидроксиды разлагаются при нагревании
Сu(ОН)2 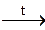 СuО + Н2О. СuО + Н2О.
| ||||
| Амфотерные гидроксиды | ||||
| Многие малорастворимые в воде гидроксиды проявляют двойственный химический характер, т.е. в кислой среде реагируют как основания, а в щелочной–как кислоты. Объясняют это тем, что эти молекулы способны диссоциировать по двум типам–по типу кислоты и по типу основания. | ||||
| К амфотерным гидроксидам относятся: Zn(ОН)2; Ве(ОН)2; Аl(ОН)3; Сr(ОН)3, Fe(OH)3, Pb(OH)2, Mn(OH)4, V(OH)3, Sn(OH)2. | ||||
Молекулы Zn(ОН)2 способны диссоциировать и как основание, и как кислота.
H+ + HZnO2- (по типу кислоты) – амфотерный гидроксид + кислота = соль + вода Zn(OH)2 + 2НСl = ZnСl2 + 2Н2О; Zn(OH)2 + 2Н+ = Zn2+ + 2Н2О; – амфотерный гидроксид + щелочь = комплексная соль Zn(OН)2 + 2NaОН- = Na2[Zn(OH)4]; Zn(OН)2 + 2ОН- = [Zn(OH)4]2-; или амфотерный гидроксид + щелочь = соль + вода Zn(OН)2 + 2NaOH = Na2ZnO2 + 2H2O; Zn(OН)2 + 2ОН-= ZnO22- + 2H2O. |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1621; Нарушение авторских прав?; Мы поможем в написании вашей работы!

