
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомно-молекулярное учение
|
|
|
|
ХИМИЯ
Учебное наглядное пособие
ХИМИЯ
Интернет - ресурсы
40. Интернет – ресурсы Минэнерго РФ.
41. Интернет - ресурсы Федеральной тарифной службы.
42. Интернет – ресурсы Системного оператора.
43. Интернет– ресурсы ИНЭИ РАН.
44. Интернет ресурсы ЗАО «АПБЭ.
45. Интернет – ресурсы «Ростепло».
46. Интернет – ресурсы ЦЭНЭФ.
47. Ветроэнергетика – Википедия..
 |
Новокузнецк
 2010
2010
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
«Сибирский государственный индустриальный университет»
Е.М.Рыбалкин
О.Ю. Ковалик
Рекомендовано редакционно-издательским советом вуза
в качестве учебного наглядного пособия
для студентов технических вузов
Новокузнецк
УДК 54 (075)
Р 931
Рецензент
зав. кафедрой химии ГОУ ВПО УГМА Росздрава,
д.х.н., профессор
Тхай В.Д.
Рыбалкин Е.М., Ковалик О.Ю.
Р 931 Химия: Учебное наглядное пособие / СибГИУ. – Новокузнецк, 2010 – 180 с.
Содержит краткий лекционный материал по всем разделам дисциплины «Химия». Является учебным пособием для самостоятельной работы студентов.
Предназначено для студентов первого курса всех специальностей.
УДК 54 (075)
© Сибирский государственный
индустриальный университет,
© Рыбалкин Е.М., Ковалик О.Ю., 2010
 | |||||
 | |||||
СОДЕРЖАНИЕ
Предисловие. 2
Раздел 1. Основные понятия и законы химии.. 2
1.1. Атомно-молекулярное учение. 2
1.2. Законы химии. 2
1.3. Эквивалент. 2
Раздел 2. Классификация неорганических веществ.. 2
2.1.Оксиды.. 2
2.2. Гидроксиды металлов. 2
2.3. Кислоты.. 2
2.4. Соли. 2
2.5. Комплексные соединения. 2
Раздел 3. Растворы... 2
3.1. Способы выражения концентрации растворов. 2
3.2. Растворы неэлектролитов. 2
3.3. Растворы электролитов. Электролитическая диссоциация. 2
3.4. Ионно-молекулярные уравнения реакций. 2
3.5. Гидролиз. 2
Раздел 4. Элекрохимические системы... 2
4.1. Степень окисления. 2
4.2. Окислительно-восстановительные реакции (ОВР) 2
4.3. Гальванический элемент Даниэля-Якоби. 2
4.4. Электродвижущая сила (ЭДС) 2
4.5. Электролиз. 2
4.6. Коррозия и защита металлов от коррозии. 2
Раздел 5. Периодический закон Д.И.Менделеева.. 2
5.1. Строение атома. 2
5.2. Модель состояния электрона в атоме. 2
5.3.Основные положения строения электронных оболочек атома. 2
Раздел 6. Химическая связь. 2
Раздел 7. Химическая кинетика и равновесие.. 2
Раздел 8. Химическая термодинамика.. 2
8.1. Параметры состояния системы.. 2
8.2. Закон Гесса. 2
Раздел 9. Химия элементов.. 2
Раздел 10. Органическая химия.. 2
10.1.Углеводороды.. 2
10.2. Кислородсодержащие органические соединения. 2
Раздел 11. Аналитическая химия……………………………2
11.1. Методы качественного анализа. 2
11.2. Методы количественного анализа. 2
11.3. Спектроскопические методы анализа. 2
11.4. Дифрактометрический метод анализа. 2
Раздел 12. Химия окружающей среды... 2
Раздел 13. Коллоидная химия.. 2
ПРИЛОЖЕНИЕ А. Физико-химические постоянные. 2
ПРИЛОЖЕНИЕ Б. Относительные электроотрицательности
элементов………….…………………………………………………... 161
Приложение В. Периодическая система элементов
Д.И. Менделеева………………………………….………………........162
Приложение Г. Растворимость веществ в воде
при температуре 250С………………..………………………………..164
Приложение Д. Эбулиоскопические и криоскопические
константы некоторых растворителей………………………….……..165
Приложение Е. Произведения растворимостей………………....165
Приложение ж. Возможные степени окисления элементов…...166
Приложение И. Электронное строение атомов в основном
состоянии……...……………………………………………………….169
Приложение К. Стандартные термодинамические
функции образования………...……………………………………….172
Приложение л. Нормальные (стандартные)
окислительно-восстановительные потенциалы…………..…………176
Предисловие
В последние годы изучение химии становится для многих студентов серьезной проблемой. Разрыв между требованиями стандартных программ и возможностями студентов ставит перед молодыми людьми труднопреодолимый барьер на пути к успешной сдаче экзаменационных испытаний.
Очевидно, что знаний в объеме образовательного стандарта средней школы недостаточно, и учащиеся нуждаются в прохождении систематического курса химии коррекционного плана, в задачи которого входит:
− углубление имеющихся химических знаний и ликвидация пробелов;
− систематизация знаний, обучение умению пользоваться справочными материалом;
− расширение кругозора учащихся.
Предлагаемое учебное пособие разрабатывалось именно в расчете на использование в этих целях. Оно содержит в себе полный курс химии, включая аналитическую химию, химию окружающей среды и коллоидную химию. Многие главы содержат дополнительный материал, который может пригодиться студенту – участнику олимпиады по химии.
Изучение курса может проходить как самостоятельно, так и во время индивидуальных занятий с преподавателем.
Авторы заранее благодарны своим читателям и будут искренне признательны за все замечания и пожелания по улучшению пособия.
Раздел 1. Основные понятия и законы химии
| ВЕЩЕСТВО | ||||
| агрегатное состояние | состав | |||
| газообразное | жидкое | твёрдое | простые | сложные |
| формы нет, объема нет, расширяется и сжимается | формы нет, объем есть, сжимается плохо | форма есть, объем есть, сжимается плохо | из атомов одного элемента. Например: О2, Н2 | из атомов разных элементов. Например: Н2O, НСl |
Химический элемент – определенный вид атомов с одинаковым положительным зарядом ядра.
Аллотропия – это явление, при котором один элемент образует простые вещества с разными свойствами. Например, О – кислород, озон: С – графит, алмаз, карбин.
| Относительная атомная масса, у.е. | Относительная молекулярная масса, у.е. |
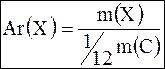 ,
где m(X) – средняя масса атома элемента ,
где m(X) – средняя масса атома элемента  ,
m(C)– масса атома углерода. ,
m(C)– масса атома углерода.
|  = =  = = + +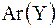 ,
где m(XY) – масса молекулы,
Ar(X), Ar(Y)– относительные атомные массы элементов X, Y. ,
где m(XY) – масса молекулы,
Ar(X), Ar(Y)– относительные атомные массы элементов X, Y.
|
| Например: Ar(O) = 15,9994 Ar(H) = 1,0079 | Например: Mr(H2О) = 2 Ar(Н) + Ar(О) = 2∙1,0079+ + 15,9994 = 18,01 |
Моль – это количество вещества, содержащее столько же структурных единиц (молекул, атомов, ионов), сколько атомов содержится в 12 г углерода 12С.
| Число структурных единиц вещества | |
где NA – число Авогадро, число частиц в одном моле: NA = 6,02·1023 моль–1, n(x) – количество вещества(моль). |
Молярная масса, г/моль
или M(x)=Mr(x), где M(x) – (г/ моль), m(x) – масса вещества(грамм), n(x) – количество вещества(моль). | |
Молярный объем
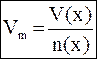 ,
где Vm – молярный объем газа(л/моль),
V(x) – объем(литр),
n(x) – количества вещества(моль). ,
где Vm – молярный объем газа(л/моль),
V(x) – объем(литр),
n(x) – количества вещества(моль).
|
| Относительная плотность – D | |
 ,
где m1 – масса определенного объема первого газа,
m2 – масса такого же объема второго газа, ,
где m1 – масса определенного объема первого газа,
m2 – масса такого же объема второго газа,
 , отсюда М1 = D∙M2
где М1, М2 – молекулярные массы 1 и 2 газа с одинаковым объемом и взятые в одинаковых условиях. , отсюда М1 = D∙M2
где М1, М2 – молекулярные массы 1 и 2 газа с одинаковым объемом и взятые в одинаковых условиях.
| |
| Например: при D(Н2) = 8 и М2(Н2) = 2 г/моль, молярная масса газа равна: М1 = D(Н2) • M2(Н2) = 8 • 2 = 16 г/моль; при D(воздух) = 1,517 и М2(воздух) = 29 г/моль, молярная масса газа равна: М1 = D(воздух) • M2(воздух) = 1,517 • 29 = 44 г/моль; | |
| Соединения | |
| Дальтониды– соединения молекулярной структуры; состав постоянный независимый от способа получения. | Бертоллиды –соединения с немолекулярной структурой (с атомной, ионной и металлической решёткой);переменного состава, который зависит от способа получения. |
| Например: Н2О, HCl, CCl4, CO2 Состав: СO2=27,27%(C)+72,73%(O) независимо от способа получения. | Например: UO3 → состав от UO2,5 до UO3; UO → состав от UO0,9 до UO1,3. Зависит от температуры и давления кислорода. |
Химические реакции – явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом не происходит изменения состава ядер атомов.
При физических явлениях изменяется форма, физическое состояние или образуются новые вещества за счет изменения состава ядер атомов.
| Классификация химических реакций | по признаку | выделения или поглощения теплоты | экзотермические H2+Cl2 = 2HCl; ∆H˚ = –184,6 кДж; |
| эндотермические N2+O2 = 2NO; ∆H˚= 180,8 кДж; | |||
| изменения числа исходных и конечных веществ соединения | соединения HCl+NH3=NH4Cl; | ||
| разложения 2HI = H2+I2; | |||
| обратимости реакции | обратимые N2+3H2 ↔ 2NH3; | ||
| необратимые 2KClO3 → 2KCl+3O2; | |||
| изменения степени окисления атомов | без изменения BaCl2+H2SO4→BaSO4+2HCl; | ||
| окислительно-восстановительные 0 +5 +2 +4 Cu+4HNO3→Cu(NO3)2+2NO2+2H2O. |
1.2. Законы химии
| Закон Бойля-Мариотта При постоянной температуре PV = const где Р – давление, V – объем. | Закон Гей-Люссака
При постоянном давлении
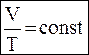 ,
где Т – температура (К),
V – объем. ,
где Т – температура (К),
V – объем.
|
Объединенный газовый закон 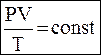
| |
Для решения задач 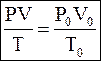 ,
где Р0, V0, T0 – давление, объем и температура газа при нормальных условиях. ,
где Р0, V0, T0 – давление, объем и температура газа при нормальных условиях.
| |
| Нормальные условия Р0 = 101325 Па, Т0 = 273 К | |
Уравнение Менделеева-Клайперона
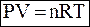 или или 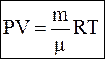 ,
где P – давление газа (Па)
V – объем (литр)
n – количество газа (моль)
m – масса (грамм)
μ – молярная масса газа (г/моль)
R – универсальная газовая постоянная R = 8,31 Дж/(моль∙) ,
где P – давление газа (Па)
V – объем (литр)
n – количество газа (моль)
m – масса (грамм)
μ – молярная масса газа (г/моль)
R – универсальная газовая постоянная R = 8,31 Дж/(моль∙)
|
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 428; Нарушение авторских прав?; Мы поможем в написании вашей работы!