
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон эквивалентов
|
|
|
|
Молярная концентрация эквивалентов вещества
Молярная масса эквивалентов
Способы выражения количества вещества эквивалентов
n(fэквХ)= ; n(fэквХ)=
; n(fэквХ)= ; n(fэквХ)=c(fэквХ)·V
; n(fэквХ)=c(fэквХ)·V
Для молярной массы эквивалентов вещества предлагается следующая запись:
 или
или 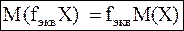
где М(Х) – молярная масса вещества.
Молярный объем эквивалентов
связан с молярным объемом газаVmследующим соотношением:
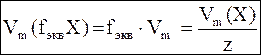 , где Vm = 22,4 л/моль (н.у.) , где Vm = 22,4 л/моль (н.у.)
|
Молярная концентрация эквивалентов вещества –это величина, равная отношению количества вещества эквивалентов растворенного вещества X к объему раствора.
c(fэквХ) = n(fэквХ)/V
Единицы измерения - моль/м, моль/дм, моль/л.
В химической реакции вещества взаимодействуют и образуются в количествах, пропорциональных их эквивалентам. (В. Рихтер, 1793 г). (первая формулировка закона).
Количества вещества эквивалентов всех веществ, участвующих в реакциях, одинаковы (вторая формулировка закона).
n(fэквХ1) = n(fэквХ2) = …= n(fэквХi )
Для реагирующих веществ, находящихся в растворе, закон эквивалентов записывают:
c(fэквХ1)·V1 = c(fэквХ2)·V2 ,
где V1, V2 – объемы растворов, с соответствующими молярными концентрациями эквивалентов.
Математическое выражение закона эквивалентов:
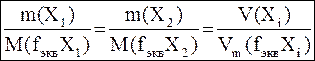
|
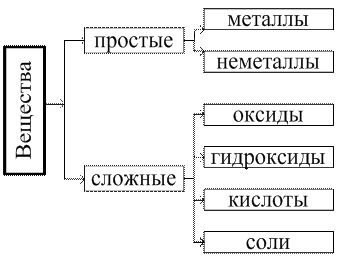
Раздел 2. Классификация неорганических веществ
 |
2.1.Оксиды
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород.
| |
| где Э – элемент, может являться металлом и неметаллом. |
| Основные оксиды – это такие оксиды, гидратные соединения которых являются основаниями. Образуются типичными металлами и d-элементами в степени окисления +2. | Кислотные оксиды – это такие оксиды, гидратные соединения которых являются кислотами. Образуются неметаллами и d-элементами в высшей степени окисления. | Амфотерные оксиды – это такие оксиды, гидратными соединениями которых могут являться и основания, и кислоты. Образуются амфотерными металлами. | ||||
| оксид | гидратное соединение | оксид | гидратное соединение | оксид | гидратное соединение | |
| Na2O | NaOH | СO2 | H2СO3 | ZnO | H2ZnO2 | Zn(OH)2 |
| СaO | Ca(OH)2 | P2O5 | H3PO4 | Al2O3 | HAlO2 | Al(OH)3 |
| FeO | Fe(OH)2 | СrO3 | H2СrO4 | Cr2O3 | HCrO2 | Сr(OH)3 |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 426; Нарушение авторских прав?; Мы поможем в написании вашей работы!