
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Згідно електролітичної дисоціації укажіть продукти дисоціації наступних солей: CuSO4, NaHCO3, KH2BO3. Дайте їм назву
|
|
|
|
Згідно електролітичної дисоціації укажіть продукти дисоціації наступних основ: Cu(OH)2, Fe(OH)3, Co(OH)3. Дайте їм назву.
Згідно теорії електролітичної дисоціації с олі -це сполуки, що у водному розчині утворюють катіони металу й аніони кислотного залишку:
MeAn D Men+ + Ann-;
Na2SO4 D 2Na+ + SO 42−
Кислі солі дисоціюють на катіон металу та аніон кислотного залишку:
NaH2PO4 D Na+ + H 2PO4−
Основні солі дисоціюють подібно до кислих. За першим ступенем сіль практично повністю розпадається на гідроксокатіони металу та аніони кислотного залишку. Гідроксокатіони, відповідно, здатні незначно дисоціювати на катіони металу та гідроксильні групи:
Fe(OH)Cl2 D Fe(OH)2+ + 2Cl-
FeOH2+ D Fe3+ + OH-
Кількісно процес електролітичної дисоціації характеризується ступенем дисоціації (ɑ) і константою дисоціації (Кд).
Ступінь дисоціації 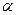 - це величина, що дорівнює відношенню концентрації електроліту, що розпався на йони, до його загальної концентрації у розчині, або відношенню числа дисоційованих молекул до загального числа молекул електроліту:
- це величина, що дорівнює відношенню концентрації електроліту, що розпався на йони, до його загальної концентрації у розчині, або відношенню числа дисоційованих молекул до загального числа молекул електроліту:
 або
або 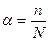 ,
,
де Сдис і Сзаг – відповідно концентрація продисоційованого електроліту і загальна концентрація, моль/л; n – число дисоційованих молекул, N – загальне число молекул електроліту. Ступінь дисоціації виражається у частках або у відсотках. Залежно від ступеня дисоціації, який виявляють сполуки у розведених розчинах, електроліти поділяють на:
- сильні (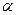 >30%);
>30%);
- середньої сили (3%< 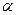 <30%);
<30%);
- слабкі (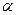 <30%);
<30%);
Слабкі електроліти. Оскільки процес дисоціації є оборотним, особливо у випадку слабких електролітів, то для його опису можна застосувати загальні закони рівноваги. Наприклад, для процесу
KtAn D Kt+ + Ann-
Вираз константи рівноваги для вказаного рівняння можна записати так:

Цю константу називають константою йонізації або константою дисоціації.
Константа дисоціації Кдис характеризує здатність речовини розпадатися у розчині на йони. Чим менше значення Кдис, тим слабкішим є електроліт, і навпаки, велике значення Кдис свідчить про високу здатність до дисоціації. Важливою ознакою константи дисоціації є те, що вона не залежить від концентрації розчину, а залежить лише від природи розчиненої речовини і розчинника та від температури. Константи дисоціації найпоширеніших кислот та основ, що зустрічаються в медичній практиці наведені в табл.10.
Таблиця 10
Константи електролітичної дисоціації кислот та основ (при 25 0С)
| Електроліти | Кд |
| Кислоти | |
| Нітритна HNO2 | 4,6 × 10–4 |
| 2-гідроксі пропанова СН3СН(ОН)СООН | 1,38 × 10–4 |
| Фторидна НF | 3,53 × 10–4 |
| Сульфітна Н2SO3 | 1,7 × 10–2 (І) 5 × 10–6(ІІ) |
| Сульфідна H2S | 8,9 × 10–8 (І) 1,3 × 10–13(ІІ) |
| Ціанідна HCN | 4,9 × 10–10 |
| Карбонова Н2СО3 | 4,45 × 10–7 (І) 4,69 × 10–11 (ІІ) |
| Етанова СН3СООН | 1,75 × 10–5 |
| Ортофосфатна Н3РО4 | 7,52 × 10–3 (І) 6,31 × 10–8 (ІІ) 1,26 × 10–12 (ІІІ) |
| Етандіова НООССООН | 6,5 × 10–2 (І) 6,1 × 10–5 (ІІ) |
| Основи | |
| Амоніак (р) NH4ОН | 1,8 × 10–5 |
| Цинк гідроксид Zn (ОН)2 | 1,5 × 10–9 |
Для електролітів, що дисоціюють ступінчасто, кожній стадії дисоціації відповідає своє значення константи дисоціації. Наприклад, для ортофосфатної кислоти Н3РО4 константи дисоціації на кожній стадії дисоціації мають наступні значення:
І 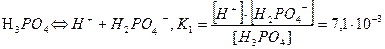 ;
;
ІІ 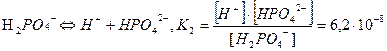 ;
;
ІІІ 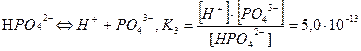
Сумарна константа дисоціації для ортофосфатної кислоти Н3РО4 дорівнює добутку констант дисоціації кожного ступеню дисоціації і приймає значення:
Кзаг = К1 × К2 × К3 = 7,1 × 10–3 × 6,2 × 10–8 × 5,0 × 10–13 = 2,2 × 10–22
Таким чином, константа дисоціації загальна дорівнює:

Якщо загальна концентрація електроліту становить С, а його ступінь дисоціації α, то рівноважна концентрація недисоційованих молекул дорівнює (С – αС), а концентрація утворених унаслідок дисоціації катіонів і аніонів – αС.
Тоді рівняння константи дисоціації матиме вигляд:
 або
або 
Це рівняння є математичним виразом закону розведення Оствальда, який пов’язує залежність константи дисоціації електроліту від ступеню дисоціації та його концентрації.
У випадку, якщо електроліт дуже слабкий, ступінь дисоціації має невелике значення (α→0), яким можна знехтувати, тоді знаменник у вказаному рівнянні (1 – α) → 1, при цьому закон розведення набуває вигляду
К = α2 С,
Звідки, ступінь дисоціації можна представити, як:
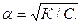
Отже, ступінь дисоціації слабкого електроліту зі зменшенням концентрації розчину збільшується, і навпаки, зі збільшенням концентрації розчину зменшується. Закон розведення справедливий тільки для розведених розчинів слабких електролітів. Проте навіть для дуже розведених розчинів сильних електролітів наведене рівняння константи дисоціації застосовувати не можна.
! Розрахуйте константу дисоціації для ацетатної кислоти СН3СООН, використовуючи відомі константи електролітичної дисоціації кислот та основ.
Сильні електроліти. Розчини сильних електролітів за фізико-хімічними властивостями значно відрізняються від розчинів слабких електролітів. Це пов’язано з тим, що в розчинах сильних електролітів йони взаємодіють між собою завдяки значним електростатичним силам, які діють між ними. До сильних електролітів належать сильні кислоти такі, як перхлоратна кислота HClO4, нітратна кислота HNO3, хлоридна кислота HCl, бромідна кислота HBr, йодидна кислота HI, хлоратна кислота HClO3, основи лужних та лужноземельних металів та переважна більшість розчинних у воді солей.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1110; Нарушение авторских прав?; Мы поможем в написании вашей работы!