
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Йонний добуток води. Водневий показник рН
|
|
|
|
Вода – це слабкий електроліт. Процес дисоціації можна представити наступною схемою:
Н2О ↔ Н+ + ОН-
Запишемо константу електролітичної дисоціації для даного рівняння:
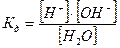 або
або 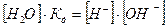
Константа електролітичної дисоціації води Н2О при 250С дорівнює 1,8·10-16. Концентрація недисоційованих молекул води  практично дорівнює її молярній концентрації. Молярна концентрація води обчислюється як відношення маси 1 л води (1000 г) до її молярної маси (18 г/моль) і дорівнює 55,56 моль/л:
практично дорівнює її молярній концентрації. Молярна концентрація води обчислюється як відношення маси 1 л води (1000 г) до її молярної маси (18 г/моль) і дорівнює 55,56 моль/л:
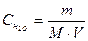 , тобто
, тобто
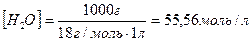
Рівняння Кд води приймає вигляд:
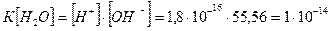
Якщо позначити 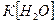 Кw , то одержимо:
Кw , то одержимо:
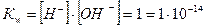
Величину Кw називають йонним добутком води. Концентрація йонів Гідрогену дорівнює концентрації гідроксид йонів:
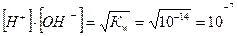 моль/л
моль/л
У нейтральному середовищі [H+]=[OH−]=10−7, якщо ж до води додати розчин якої-небудь кислоти, то концентрація йонів Гідрогену збільшиться, що призведе до зменшення концентрації гідроксид йонів, тобто [H+ ] > [OH− ], проте добуток концентрацій цих йонів залишиться сталим. Наприклад, у разі додавання до води 0,001 М розчину хлоридної кислоти концентрація йонів Гідрогену буде визначатися загальною концентрацією кислоти, тобто [H+] = 10-3 моль/л, а концентрацію гідроксид йонів можна знайти зі співвідношення:
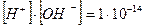
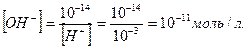
Урозчинах лугів концентрація йонів Гідрогену значно менша, ніж концентрація гідроксид йонів. Наприклад, у 0,001 М розчині натрій гідроксиду концентрація гідроксид йонів дорівнює концентрації лугу, тобто [OH-]=10-3моль/л, а концентрація йонів Гідрогену:
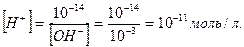
Проводити розрахунки концентрації йонів Гідрогену та гідроксид йонів через від`ємний ступінь не зручно – дуже малі дробові числа. Тому, за пропозицією Серенсена (1909) стали використовувати водневий показник рН – від’ємний десятковий логарифм концентрації іонів Гідрогену:
рН= - lg [Н+]
Аналогічно виражають концентрацію гідроксо-іонів (гідроксильний показник):
рОН = - lg [ОН-]
Якщо величину 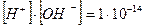 виразити у логарифмічній формі, одержимо:
виразити у логарифмічній формі, одержимо:
рН+рОН=14
Отже, величина рН є кількісною мірою кислотності середовища:
- у нейтральному середовищі рН=7;
- у кислому середовищі рН<7;
- у лужному середовищі рН > 7.
Найчастіше рН середовища визначають за допомогою індикаторів – речовин, що змінюють забарвлення (табл. 11). Кислотно-основні індикатори - це органічні речовини, які здатні змінювати колір в розчині при зміні рН середовища, або за наявності в досліджуваному зразку кислоти або лугу. До таких індикаторів відносять: лакмус, фенолфталеїн, метиловий оранжевий, метиловий червоний тощо. Одна крапля такого індикатора дозволяє зробити висновок про кислотне, нейтральне або лужне середовище. Індикаторний папір випускається у вигляді індикаторних смужок або тест-смужок для визначення кислотності або рН. Такі смужки випускаються в різних варіантах: з нанесенням кольорової шкали на упаковку, з надрукованими значеннями рН на смужці, з індикаторною шкалою на самій тест-смужці.
Таблиця 11
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2362; Нарушение авторских прав?; Мы поможем в написании вашей работы!