
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие. Реакции, протекающие в двух взаимно противоположных направлениях, называют обратимыми
|
|
|
|
Реакции, протекающие в двух взаимно противоположных направлениях, называют обратимыми. Реакцию, протекающую в правую сторону (®), называют прямой, а в левую () – обратной.
Химическим равновесием называется такое состояние системы, при котором скорости прямой и обратной реакций равны. При этом равенство  является кинетическим условием равновесия, а равенство D G Р.Т = 0 – термодинамическим.
является кинетическим условием равновесия, а равенство D G Р.Т = 0 – термодинамическим.
Концентрации реагирующих веществ, установившиеся к моменту наступления равновесия, называются равновесными.
Константой равновесия К р химической реакции называется величина, равная отношению констант скоростей прямой и обратной реакции или отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях, равных их коэффициентам в уравнении реакции. Т.е. для обратимой реакции:
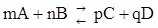 ,
,
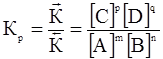 . (15)
. (15)
Константа равновесия зависит от природы реагирующих веществ и температуры и не зависит от исходных концентраций веществ в системе.
В случае гетерогенных реакций концентрации веществ, находящихся в твёрдой фазе, постоянны и не входят в выражение константы равновесия.
Система находится в равновесии, пока сохраняются постоянными условия, при которых оно установилось (концентрации, температура, давление). При изменении одного из условий происходит изменение равновесных концентраций реагирующих веществ, называемое смещением или сдвигом химического равновесия. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится в направлении, ослабляющем это воздействие.
Так, повышение температуры приводит к смещению равновесия в сторону реакции, идущей с поглощением тепла, т.е. эндотермической, а понижение – в сторону экзотермической.
Повышение давления смещает равновесие в сторону реакции, идущей с уменьшением числа газообразных молекул, т.е. с понижением давления, и, наоборот, понижение давления смещает равновесие в сторону реакции, идущей с повышением давления.
Уменьшение концентрации одного из веществ, участвующих в реакции, приводит к смещению равновесия в сторону образования этого вещества, а увеличение – в сторону его расхода.
Стандартная энергия Гиббса DG0 связана с константой равновесия химической реакции Кр следующим уравнением:

 (16)
(16)
Пример 1. Константа равновесия гомогенной системы А(г) + В(г)  2С(г) равна 0,5. Вычислите равновесные концентрации реагирующих веществ С р, если начальные концентрации равны С Ан=3 моль/л, С Вн=5 моль/л.
2С(г) равна 0,5. Вычислите равновесные концентрации реагирующих веществ С р, если начальные концентрации равны С Ан=3 моль/л, С Вн=5 моль/л.
В начальный момент вещества С не было. Составим таблицу концентраций:
| Концентрации | Вещество | ||
| А | В | С | |
| С н | - | ||
| D С | х | х | 2 х |
| С р | 3- х | 5- х | 2 х |
Пусть к моменту установления равновесия С Ан и С Вн уменьшатся на x молей. Так как из 1 моля А и В образуется 2 моля вещества С, то D С С= 2 х моль/л. В выражение константы равновесия входят равновесные концентрации веществ:

Подставив значения, получим:

Отсюда 4 х = 0,5(15-8 х + х 2); х = 1 моль/л.
Таким образом, искомые равновесные концентрации равны:
С Ар = 3-1 = 2 моль/л; С Вр = 5-1 = 4 моль/л; С Ср = 2×1 = 2 моль/л.
Пример 2. При синтезе аммиака  равновесие установилось при следующих концентрациях веществ (моль/л):
равновесие установилось при следующих концентрациях веществ (моль/л):  = 2,5;
= 2,5; 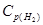 = 1,8;
= 1,8; 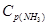 = 3,6. Рассчитайте константу равновесия реакции и исходные концентрации азота и водорода. При каких условиях равновесие данной реакции смещается в сторону синтеза аммиака?
= 3,6. Рассчитайте константу равновесия реакции и исходные концентрации азота и водорода. При каких условиях равновесие данной реакции смещается в сторону синтеза аммиака?
Определим константу равновесия К с этой реакции


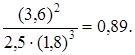
Составляем таблицу. Исходные концентрации находим по уравнению реакции.
| Концентрации | Вещество | ||
| Н 2 | N 2 | NH 3 | |
| С н | 7,2 | 4,3 | – |
| D С | 5,4 | 1,8 | 3,6 |
| С р | 1,8 | 2,5 | 3,6 |
В начальный момент аммиака в системе не было, т.е. С н (NH3) = 0.
По уравнению реакции на образование 2-х молей NH3 расходуется 1 моль N2, а на образовании 3,6 молей NH3 израсходовано 3,6: 2 = 1,8 молей азота. Тогда начальная концентрация азота:
C н (N2) = C p (N2) + D С = 2,5 + 1,8 = 4,3 моль/л.
Аналогично на образование 2-х молей NH3 необходимо израсходовать 3 моля H 2, а для получения 3,6 молей NH3 требуется
 моля, т.е. C н (Н2) = 1,8 + 5,4 = 7,2 моль/л.
моля, т.е. C н (Н2) = 1,8 + 5,4 = 7,2 моль/л.
Чтобы сместить равновесие эндотермической реакции синтеза аммиака в сторону прямой реакции, нужно:
а) повысить температуру, т.к. реакция эндотермическая;
б) увеличить давление, т.к. прямая реакция идёт с уменьшением давления, т.е. с образованием меньшего числа молей газа;
в) увеличить концентрации N2 и H2 и уменьшить концентрацию NH3.
Пример 3. Химическое равновесие реакции  (г) установилось при следующих концентрациях реагирующих веществ (моль/л):
(г) установилось при следующих концентрациях реагирующих веществ (моль/л): 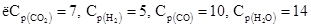 . Равновесие системы было нарушено из-за уменьшения концентрации Н2О до 11 моль/л. Вычислите новые равновесные концентрации реагирующих веществ (С ¢р) после смещения равновесия. Составляем таблицу.
. Равновесие системы было нарушено из-за уменьшения концентрации Н2О до 11 моль/л. Вычислите новые равновесные концентрации реагирующих веществ (С ¢р) после смещения равновесия. Составляем таблицу.
| Концентрации | Вещество | |||
| СО2 | Н2 | СО | Н2О | |
| С н | ||||
| D С | х | х | х | х |
| С ¢р | 7-х | 5-х | 10+х | 11+х |
Согласно принципу Ле Шателье, при уменьшении концентрации Н2О равновесие сместилось в сторону прямой реакции, т.е. концентрации СО2 и Н2 уменьшились, а СО и Н2О увеличились на одинаковую величину, т.к. все вещества реагируют в одинаковом соотношении.
Обозначим изменение концентраций всех веществ через х моль/л. После смещения равновесия новые равновесные концентрации реагирующих веществ стали (см. последнюю строку таблицы).
Используя первую строку таблицы, вычислим константу равновесия для данной реакции:
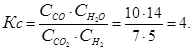
В уравнение для константы подставим новые равновесные концентрации
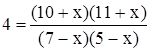 .
.
Раскроем это выражение: 140 – 48 х + х 2 = 110 + 21 х + х 2.
Упростим: х 2 – 23 х + 10 = 0.
Вычислим корни уравнения  .
.
Первый корень х1=22,6 отбрасываем, т.к. уменьшение концентраций СО2 и Н2 не может быть больше, чем исходные концентрации этих веществ;
х2 = 0,44 моль/л.
Следовательно, после смещения равновесия новые равновесные концентрации реагирующих веществ стали (моль/л):

Пример 4. Рассчитайте стандартную энергию Гиббса химической реакции при 800 К, если константа равновесия Кр =108.
Подставляя в уравнение  численные значения, получаем:
численные значения, получаем:
 .
.
ЗАДАЧИ
61. Константа равновесия гомогенной системы 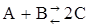 равна 50. Вычислите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л.
равна 50. Вычислите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л.
Ответ: СА = 0,06; СВ = 0,26; СС = 0,88 моль/л.
62. Реакция протекает по уравнению СО(г) + Сl2(г) «COCl2(г). Начальные концентрации СО и Cl2 равны (моль/л): ССО =0,28; ССl2 =0,09. Равновесная концентрация СО равна 0,2 моль/л. Вычислите константу равновесия.
Ответ: 40.
63. Реакция протекает по уравнению А(г) + В(г) «С(г) + D(г). Исходные концентрации веществ А и В 0,8 моль/л, а равновесная концентрация С 0,6 моль/л. Вычислите константу равновесия.
Ответ: 9.
64. В системе  равновесные концентрации равны (моль/л):
равновесные концентрации равны (моль/л): 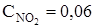 ; С NO = 0,24;
; С NO = 0,24;  = 0,12. Вычислите константу равновесия и исходную концентрацию NO2.
= 0,12. Вычислите константу равновесия и исходную концентрацию NO2.
Ответ: 1,92; 0,3 моль/л.
65. Равновесные концентрации в системе N2O4 «2NО2 равны: 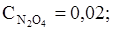
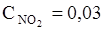 моль/л. Вычислите равновесные концентрации после смещения равновесия в результате увеличения давления в 3 раза.
моль/л. Вычислите равновесные концентрации после смещения равновесия в результате увеличения давления в 3 раза.
Ответ: 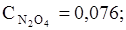
 моль/л.
моль/л.
66-69. Химическое равновесие гомогенной системы  установилось при концентрациях (моль/л), указанных в таблице. Затем концентрацию одного из веществ увеличили (+) или уменьшили (-) на величину, указанную в скобках. Вычислите новые равновесные концентрации веществ после смещения равновесия.
установилось при концентрациях (моль/л), указанных в таблице. Затем концентрацию одного из веществ увеличили (+) или уменьшили (-) на величину, указанную в скобках. Вычислите новые равновесные концентрации веществ после смещения равновесия.
| № задачи | А | В | С | D |
| 6(-6) | ||||
| 0,04 | 0,64(+0,96) | 0,16 | 0,16 | |
| 8(+8) | ||||
| 12(-12) |
Ответы: 66) СА = 6,52; СВ = 5,52; СС = 2,48; СD =14,48 моль/л.
67) СА = 0,02; СВ = 1,58; СС = 0,18; СD = 0,18 моль/л.
68) СА = 2,85; СВ = 20,85; СС = 3,15; СD =15,15 моль/л.
69) СА = 13,04; СВ = 11,04; СС = 4,96; СD =28,96 моль/л.
70. Химическое равновесие реакции А(г) «В(г) + С(г) установилось при следующих концентрациях реагирующих веществ (моль/л): СА=10; СВ= 2; СС= 4. В равновесную систему добавили вещество С в количестве 4 моль/л. Вычислите новые равновесные концентрации реагирующих веществ после смещения равновесия.
Ответ: СА = 10,8; СВ = 1,2; СС = 7,2 моль/л.
71. Равновесные концентрации веществ, участвующих в реакции
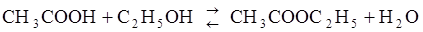 , равны (моль/л):.
, равны (моль/л):. 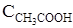 = 0,02;
= 0,02;  = 0,32;
= 0,32; 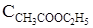 = 0,08;
= 0,08; 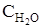 = 0,08. Вычислите новые равновесные концентрации после смещения равновесия вследствие увеличения концентрации С2Н5ОН в 4 раза.
= 0,08. Вычислите новые равновесные концентрации после смещения равновесия вследствие увеличения концентрации С2Н5ОН в 4 раза.
Ответ: 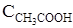 = 0,007;
= 0,007;  = 1,267;
= 1,267; 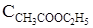 =
= 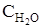 =0,093 моль/л.
=0,093 моль/л.
72. При температуре 900 К константа равновесия равна 100. Вычислите стандартную энергию Гиббса при этой температуре.
Ответ: D G 0 = - 34,4 кДж/моль.
73. Стандартная энергия Гиббса равна – 46 кДж/моль. Вычислите константу равновесия реакции при 600 К.
Ответ: 104.
74. Исходные концентрации SO2 и O2 в системе  соответственно равны (моль/л): 0,03 и 0,015. К моменту наступления равновесия концентрация SO2 стала равной 0,01 моль/л. Вычислите равновесные концентрации остальных реагирующих веществ.
соответственно равны (моль/л): 0,03 и 0,015. К моменту наступления равновесия концентрация SO2 стала равной 0,01 моль/л. Вычислите равновесные концентрации остальных реагирующих веществ.
Ответ:  = 0,005;
= 0,005; 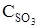 = 0,02 моль/л.
= 0,02 моль/л.
75. Исходные концентрации NO и Cl2 в системе 2NO + Cl2 «2NOCl равны (моль/л): CNO = 0,5; 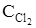 = 0,2. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
= 0,2. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
Ответ: 0,416.
76. В системе H2(г) + I2(г) «2НI(г) установились к моменту равновесия следующие концентрации реагирующих веществ (моль/л):  = 0,25;
= 0,25; 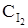 = 0,05; CHI = 0,9. Вычислите начальные концентрации.
= 0,05; CHI = 0,9. Вычислите начальные концентрации.
Ответ:  = 0,7;
= 0,7; 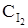 = 0,5 моль/л.
= 0,5 моль/л.
77. Равновесные концентрации веществ в системе CO + Cl2 «COCl2 равны (моль/л): CCO = 0,02;  ;
;  = 0,02 моль/л. Равновесие нарушено вследствие увеличения концентрации Cl2 до 0,03 моль/л. Вычислите новые равновесные концентрации после смещения равновесия.
= 0,02 моль/л. Равновесие нарушено вследствие увеличения концентрации Cl2 до 0,03 моль/л. Вычислите новые равновесные концентрации после смещения равновесия.
Ответ: CCO = 0,013; 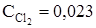 ;
;  = 0,027 моль/л.
= 0,027 моль/л.
78. Равновесные концентрации веществ, участвующих в реакции  , равны (моль/л):
, равны (моль/л):  = 0,005;
= 0,005; 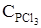 = 0,06;
= 0,06; 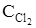 =0,08. Вычислите новые равновесные концентрации после смещения равновесия вследствие увеличения концентрации хлора в 2 раза.
=0,08. Вычислите новые равновесные концентрации после смещения равновесия вследствие увеличения концентрации хлора в 2 раза.
Ответ:  = 0,009;
= 0,009; 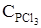 = 0,056;
= 0,056; 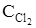 = 0,156 моль/л.
= 0,156 моль/л.
79-80. Реакции протекают по уравнению 2A «2B + C. Найдите начальную концентрацию вещества А при заданной константе равновесия К и равновесной концентрации вещества С, моль/л.
| № задачи | К | [ C ] |
| 0,4 |
Ответы: 79) 6; 80) 1,3.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1062; Нарушение авторских прав?; Мы поможем в написании вашей работы!