
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет нормальной концентрации 1 страница
|
|
|
|
Нормальная концентрация (эквивалентная) показывает количество эквива лентов растворенного вещества в 1 л раствора.
СN=  =
= 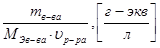 . (18)
. (18)
Количество эквивалентов растворенного вещества определяется:
n Э в-ва = 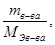
 ® CN =
® CN = 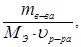
где n Э в-ва – число эквивалентов растворенного вещества, г/экв.;
m в-ва – масса растворенного вещества, г;
M Э в-ва – масса эквивалента растворенного вещества, г/экв;
u р-ра – объем раствора, л.
Рассчитаем массу эквивалента К2СО3. Масса 1 моля К2СО3 равна:


Масса моль – эквивалента К2СО3: 

где В – суммарная валентность катиона или аниона соли и для К2СО3 равна 2.
Вычислим количество грамм-эквивалентов К2СО3 в растворе:
n  =
=  .
.
Определим объем полученного раствора по формуле:
u= 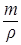 ,
,
где m – масса раствора, г;
u - объем раствора, мл;
r - плотность раствора, г/см3.
u 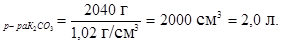
По определению найдем нормальную концентрацию раствора:
С N = 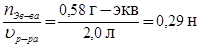 .
.
Расчет молярной концентрации
Молярная концентрация определяется количеством молей растворенного вещества, содержащихся в 1 л раствора. Количество молей растворенного вещества равно:
n в-ва = 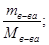
следовательно, молярная концентрация раствора:
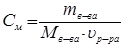 ,
,  (19)
(19)
где n – количество молей растворенного вещества, моль;
m в-ва- масса растворенного вещества, г;
M в-ва- молекулярная масса растворенного вещества, г/моль;
u р-ра- объем раствора, л.
Зная процентную концентрацию и плотность (r) полученного раствора, можно определить молярную концентрацию этого раствора.
Масса 1л раствора К2СО3:
m р-ра = uр-ра × r = 1000 см3×1,02 г/см3 = 1020 г.
Теперь определим массу растворенного К2СО3 в 1 л раствора:
m  = m р-ра × w
= m р-ра × w  ,
,
где w  =
= 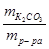 - массовая доля растворенного вещества, равная отношению массы растворенного вещества к массе всего раствора:
- массовая доля растворенного вещества, равная отношению массы растворенного вещества к массе всего раствора:
w  =
=  .
.
Отсюда m 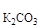 = 1020 г × 0,0196 =19,99 г.
= 1020 г × 0,0196 =19,99 г.
Находим молярную концентрацию раствора, т.е. количество молей К2СО3 в 1 л раствора:
СМ= 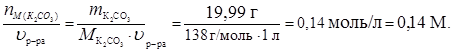

Расчет моляльной концентрации раствора
Моляльность раствора (Сm) показывает количество молей растворенного вещества, содержащихся в 1000 г растворителя:
Сm= 
 ;
;
т.к. nM = 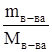 ,
,
где n M - количество молей растворенного вещества;
m в-ва – масса растворенного вещества, г;
M в-ва – молярная масса растворенного вещества, г/моль;
m р-ля – масса растворителя, кг,
то Сm =  .
.  (20)
(20)
Найдем массу К2СО3, растворенного в 1 кг растворителя (Н2О). Для этого определим массовую долю растворителя wр-ля:
w  =
= 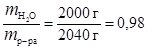 .
.
Масса К2СО3 в одном кг растворителя:
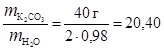 .
.
Пример 2. Вычислите массовые доли веществ в растворе, полученном при сливании 100 мл 10%-го раствора СаСl2 (r1= 1,083 г/мл) и 150 мл 4%-го раствора Nа3РО4(r2 = 1,04 г/мл) после отделения образовавшегося осадка.
Решение. Запишем уравнение реакции, протекающей при сливании данных растворов:
3СаСl2 + 2Nа3РО4 = 6NаСl + Cа3 (РО4)2¯.
Эта реакция необратима, т.к. Cа3(РО4)2 выпадает в осадок.
Разобьем решение задачи на следующие этапы:
1) Вычислим массы растворов и растворенных веществ.
Раствор СаСl2: m1 (р-ра) = r1× u1 = 1,083 × 100 = 108,3 г.
Раствор Nа3РО4: m2 (р-ра) = r2 × u2 = 1,04 × 150 = 156 г.
m CаСl  = m1 × w1 = 108,3 × 0,1 = 10,83 г,
= m1 × w1 = 108,3 × 0,1 = 10,83 г,
т.к.× w1 = 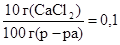 ;
;
m Nа  РО
РО  = m2 × w2 = 156 × 0,04 = 6,24 г,
= m2 × w2 = 156 × 0,04 = 6,24 г,
т.к.× w2 = 
2) Находим количество вещества СаСl2 и Nа3РО4::
n CаСl  =
=  ;
;
n  =
=  .
.
3) Из уравнения реакции видим, что вещества реагируют в соотношении 3:2 и из расчета по этапу 2) очевидно, что СаСl2 находится в избытке, а Nа3РО4 прореагирует полностью.
4) Находим массы образовавшихся веществ, т.к. количество образовавшегося фосфата кальция в 2 раза меньше количества молей Nа3РО4, вступившего в реакцию:
n  =
= 

 ,
,
m  0,01904×310,2 = 5,906 г;
0,01904×310,2 = 5,906 г;
n NаСl = 3n(  )
)  = 0,1142 моль;
= 0,1142 моль;
mNаСl = n×M = 0,1142 × 58,44 = 6,674 г.
5) Находим массу остатка СаСl2; прореагировало СаСl2:
n 3 = 3/2 n( 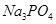 ) =0,05711 моль;
) =0,05711 моль;
m 1(CаСl  ) =n3×MCаСl
) =n3×MCаСl  = 6,339 г;
= 6,339 г;
m остатка= 10,83 - 6,339 = 4,491 г.
6) Вычислим массу образовавшегося раствора:
m 3(р-ра)= m 1(р-ра)+ m 2(р-ра) – m 
 = 108,3 + 156 – 5,906 = 258,39 г.
= 108,3 + 156 – 5,906 = 258,39 г.
7) Вычислим массовые доли солей в растворе:

w NаСl = 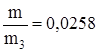 .
.
Пример 3. На нейтрализацию 50 см3 раствора НСl израсходовано 25 см3 0,5 н раствора едкого натра. Чему равна нормальность кислоты?
Решение. Как видно из уравнения, растворы взаимодействуют в эквивалентных количествах:
НСl + NаОН = NаСl + Н2О.
При разных нормальностях растворы реагирующих веществ взаимодействуют между собой в объемах, обратно пропорциональных их нормальностям:
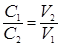 или С 1× V 1 = C 2× V 2, (21)
или С 1× V 1 = C 2× V 2, (21)
где С 1, С 2 – нормальные концентрации НСl и NаОН соответственно,
V 1, V 2 – объемы растворов НСl и NаОН.
С 1×50 = 25×0,5; С 1 =  .
.
ЗАДАЧИ
101. К 1 л 10%-го раствора КОН (r = 1,092 г/мл) прибавили 0,5 л 5%-го раствора КОН (r = 1,045 г/мл). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Ответ: 1,2 М.
102. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н раствора Н2SO4 прибавить 125 см3 0,2 н раствора КОН.
Ответ: 0,14 г КОН.
103. Для осаждения в виде АgCl всего серебра, содержащегося в 100 см3 раствора АgNО3, потребовалось 50 см3 0,2 н раствора НСl. Чему равна нормальность раствора АgNO3.Сколько граммов АgCl выпало в осадок?
Ответ: 0,1 н; 1,433 г.
104. Какой объем 0,3 н раствора НСl требуется для нейтрализации раствора, содержащего 0,32 г NаОН в 40 см3?
Ответ: 26,6 см3.
105. На нейтрализацию 31 см3 0,16 н раствора щелочи потребуется 217 см3 раствора Н2SO4. Чему равна нормальность раствора кислоты?
Ответ: 0,023 н.
106. Сколько граммов НNO3 содержалось в растворе, если на его нейтрализацию потребовалось 35 см3 0,4 н раствора NаОН?
Ответ: 0,882 г.
107. Определите объем раствора 1,2 М NаОН, который потребуется для полного осаждения железа в виде гидроксида из раствора FеСl3 с массой 300 г с массовой долей соли в нем 12%.
Ответ: 554 мл.
108. 1 л 0,5 М раствора едкого натра смешали с 1 л 0,4 н раствора серной кислоты. Сколько молей и какого вещества осталось в избытке?
Ответ: 0,1 моль NаОН.
109. На нейтрализацию 10 мл раствора едкого натра пошло 6 мл 0,5 н раствора НСl. Вычислите нормальность раствора щелочи.
Ответ: 0,3 н.
110. Сколько миллилитров 2 н раствора Nа2СО3 надо прибавить к 50 мл 1,5 н раствора ВаСl2, чтобы полностью осадить барий в виде ВаСО3?
Ответ: 37,5 мл.
111. Смешивают раствор едкого натра, содержащий 8 г NаОН в 1 л, с раствором соляной кислоты, содержащим 24 г НСl в 1 л. В каком объемном соотношении нужно взять растворы, чтобы произошла полная нейтрализация.
Ответ: 3,3 объёма NаОН на 1 объём НСl?
112. Вычислить молярность 20%-го раствора НСl плотностью 1,10 г/мл
Ответ: 6,03 М НСl.
113. Какой объем 20,01%-го раствора НСl (r = 1,100 г/мл) требуется для приготовления 1 л 10,17%-го раствора (r= 1,050 г/мл)?
Ответ: 485,38 см3.
114. Какой объем 50 %-го раствора КОН (r = 1,538 г/мл) требуется для приготовления 3 л 6%-го раствора плотностью 1,048 г/мл?
Ответ: 245,5 мл.
115. Смешали 10 см3 10%-го раствора НNО3 (r = 1,056 г/мл) и 100 см3 30%- го раствора НNО3 (r = 1,184 г/мл). Вычислите процентную концентрацию полученного раствора.
Ответ: 28,38%.
116. Определите массу осадка, который образуется при смешении раствора с массовой долей хлорида бария 5% и раствора с массовой долей сульфата натрия 8%. Масса раствора ВаСl2 равна 15 г, раствора Nа2SO4- 10 г.
Ответ: m ВаSO 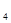 = 0,84 г.
= 0,84 г.
117. Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массой долей NаNO3 40%, плотность которого 1,32 г/мл?
Ответ: 6,2 моль.
118. Определите массовую долю хлорида кальция в растворе 1,4 М СаСl2, плотность которого равна 1,12 г/мл.
Ответ: 0,139.
119. Какой объем раствора с массовой долей карбоната натрия 0,15 (r= 1,16 г/мл) надо взять для приготовления раствора 0,45 М Nа2СО3 объемом 120 мл?
Ответ: 32,9 мл.
120. К 3л 10 %-го раствора НNO3 плотностью 1,054 г/мл прибавили 5 л 2%-го раствора той же кислоты плотностью 1,009 г/мл. Вычислите процентную и молярную концентрации полученного раствора, объем которого равен 8 л.
Ответ: 5,0%, 0,82 М.
6.2 Растворы электролитов
Электролитами называются вещества, которые при растворении в воде диcсоциируют (распадаются) на ионы и проводят электрический ток. Неорганические кислоты, основания и соли являются электролитами.
Сила электролита характеризуется степенью диссоциации (a), которая показывает отношение числа молекул, продиссоциированных на ионы (Nд), к общему числу молекул электролита в растворе (Nо), и выражается в процентах: 
a = 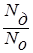 100%. (22)
100%. (22)
Условно считают электролиты, диссоциированные на 3% и менее (т.е. a £ 3%) – слабыми, а на 30% и более (a ³ 30%) – сильными.
В растворе слабого электролита устанавливается равновесие между недиссоциированными молекулами и продуктами их распада – ионами. Например, в растворе уксусной кислоты:
СН3СООН «СН3СОО- + Н+
Константа такого равновесия выражается через концентрации соответствующих частиц в растворе и называется константой диссоциации КД. :
Кд = 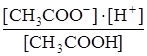 (23)
(23)
Многоосновные кислоты диссоциируют по ступеням, каждая из которых характеризуется своей константой. Например:
Н3ВО3 «Н+ + Н2ВО 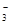 К1
К1
Н2ВО  «Н+ + НВО
«Н+ + НВО  К2
К2
НВО  «Н+ + ВО
«Н+ + ВО 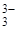 К3
К3
Согласно закону разбавления Оствальда, Кд и a связаны уравнением
К д = 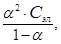 (24)
(24)
где Сэл – молярная концентрация электролита, моль/л.
При a<<1 уравнение упрощается:
К д = a2× C эл. (25)
Для расчетов, связанных с диссоциацией кислот, часто используют не Кдис, а показатель константы диссоциации рК, который равен:
рК = -lg К д. (26)
С возрастанием Кд, т.е. с увеличением силы кислоты, значение рК уменьшается, следовательно, чем больше рК, тем слабее кислота. Так, значения рК для слабых кислот от СН3СООН до НСN лежат в пределах от 4,76 до 9,21.
Для одноосновных кислот, например уксусной – СН3СООН, концентрации[Н+ ] и [А-] равны и составляют:
[Н+ ]=[СН3СОО-] = a× Сэл.
С учетом уравнения (25) имеем:
[Н+ ]=[ СН3СОО-]= Сэл × 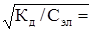
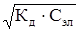 .
.
Пример 1. Степень диссоциации СН3СООН в 0,1М растворе равна 1,32×10-2. Найдите константу диссоциации кислоты и значение рК. По величине рК сделайте вывод о силе кислоты.
Решение. Запишем уравнение диссоциации уксусной кислоты:
СН3СООН«Н+ + СН3СОО–
Подставим данные задачи в уравнение Оствальда:
К Д = 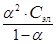 =
= 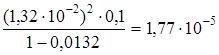 .
.
Откуда рК = -lg К Д = -lg(1,77×10-5) = 5- lg1,77 =5-0,25 = 4,75.
Пример 2. Какова концентрация ионов водорода в 0,1 М растворе германиевой кислоты Н2GеО3, если константа диссоциации кислоты по первой ступени равна 2,6×10-9?
Решение. Запишем уравнение диссоциации германиевой кислоты по первой ступени:
Н2GеО3 «Н+ + НGеО 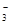
С н+ = 
 = 1,61×10-5 г-ион/л.
= 1,61×10-5 г-ион/л.
В насыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
ВаSO4 «Ва2+ + SO 
в осадке в растворе
По закону действующих масс:
К равн. =  или К равн× С ВаSO
или К равн× С ВаSO  = C Ва
= C Ва  × С
× С  ,
,
где К равн – константа равновесия;
C Ва  , С
, С  , С ВаSO
, С ВаSO 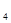 – концентрации катиона, аниона и электролита (в осадке).
– концентрации катиона, аниона и электролита (в осадке).
Концентрация твердой фазы остается неизменной и её условно принимают равной единице, а величину К равн× С ВаSO 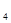 называют произведением растворимости и обозначают ПР:
называют произведением растворимости и обозначают ПР:
ПР = К равн × С ВаSO 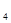 или ПР = C Ва
или ПР = C Ва  × С
× С  . (27)
. (27)
Величина ПР является важной термодинамической константой и характеризует равновесие между насыщенным раствором и твердой фазой. С помощью ПР можно решать многие вопросы химической практики.
Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его ПР. Растворение осадка такого электролита происходит, когда произведение концентраций его ионов меньше, чем ПР.
Пример 3. Произведение растворимости Аg2Cr2O7 равно 2,0×10-7.
Вычислить концентрацию ионов Аg+ в насыщенном растворе Аg2Cr2O7, не содержащем одноименных ионов.
Решение. Уравнение диссоциации Аg2Cr2O7 имеет вид:
Аg2Cr2O7 = 2Аg+ + Cr2O 
Поэтому ПР = С 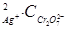 = 2,0×10-7.
= 2,0×10-7.
Так как при диссоциации Аg2Cr2O7 ионов Cr2O  получается в 2 раза меньше, чем ионов Аg+, следовательно:
получается в 2 раза меньше, чем ионов Аg+, следовательно:
Cr2O 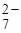 =
= 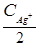 ; C
; C  ×
× 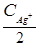 = 2,0×10-7;
= 2,0×10-7;
C 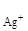 =
= 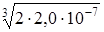 =
= 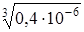 = 0,74×10-2 моль/л.
= 0,74×10-2 моль/л.
Пример 4. Установлено, что произведение растворимости ПР равно 5,6×10-16. Выпадает ли осадок при смешивании равных объемов растворов 0,02М МnSO4 и 0,01М (NН4)2S?
Решение. Запишем уравнение реакции:
МnSO4 + (NН4)2S = МnS¯ + (NН4)2SO4
При смешении двух растворов объем раствора увеличивается вдвое, а концентрации взятых веществ в смеси будут в 2 раза меньше.
Концентрация раствора МnSO 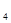 будет равна 0,01 моль/л, а раствора (NН
будет равна 0,01 моль/л, а раствора (NН  )
)  S – 0,005 моль/л.
S – 0,005 моль/л.
СS  = 0,005 г-ион/л, СМn
= 0,005 г-ион/л, СМn  = 0,01 г-ион/л.
= 0,01 г-ион/л.
Отсюда СS  × СМn
× СМn  = 0,01×0,005 = 5×10-5, что больше, чем ПРМnS =5,6×10-16. Следовательно, осадок выпадает.
= 0,01×0,005 = 5×10-5, что больше, чем ПРМnS =5,6×10-16. Следовательно, осадок выпадает.
Водородный показатель – рН
Вода частично диссоциирована:
Н2О «Н+ + ОН–
По закону действующих масс:
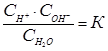 Д; К Д. × С Н
Д; К Д. × С Н  O = С н
O = С н  × С он - = К Н
× С он - = К Н  O.
O.
К Н  O – ионное произведение воды. На основании опыта установлено, что при t = 250С оно составляет 10-14 (моль/л)2. Тогда для чистой воды:
O – ионное произведение воды. На основании опыта установлено, что при t = 250С оно составляет 10-14 (моль/л)2. Тогда для чистой воды:
К Н  O = 10-14 = С н
O = 10-14 = С н  × С он -; (28)
× С он -; (28)
С н  = С он - =
= С он - =  = 10-7моль/л.
= 10-7моль/л.
Для удобства расчетов используют водородный показатель рН:
рН = – lg Сн  .
.
рН – величина, характеризующая характер среды. При рН< 7 – кислая среда, т.к. Сн  >> Сон -, при рН = 7- среда нейтральная и Сн
>> Сон -, при рН = 7- среда нейтральная и Сн  = Сон -, при рН >7 – щелочная среда, т.к. Сн
= Сон -, при рН >7 – щелочная среда, т.к. Сн  << Сон -.
<< Сон -.
Из вышеизложенного справедливо уравнение
рН + рОН = 14.
Пример 5. Чему равна концентрация ОН- – ионов в растворе, рН которого равен 10,80?
Решение. Воспользуемся приведенной формулой:
рОН = 14-рН = 14 - 10,80 = 3,20.
- lg[ОН-] = 3,2; lg[ОН-] = - 3,20.
По таблице антилогарифмов находим, что [ОН-] = 6,31×10-4 моль/л.

|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2800; Нарушение авторских прав?; Мы поможем в написании вашей работы!