
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тест тапсырмалары 2 страница. Мысалы, 0,40 М құмырсқа қышқылы мен 1,0 М құмырсқа қышқылды натрий (натрий формиаты) қоспасы
|
|
|
|
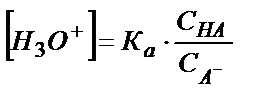 ;
;  (5.23)
(5.23)
Мысалы, 0,40 М құмырсқа қышқылы мен 1,0 М құмырсқа қышқылды натрий (натрий формиаты) қоспасы бар ертіндінің рН табайық:
НСООН + Н2О ↔ Н3О+ + НСОО- (5.24)
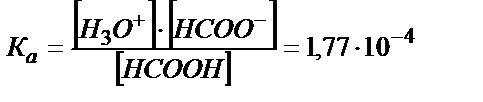 ; Кв = КW /Ка = 5,6. 10-11
; Кв = КW /Ка = 5,6. 10-11
Ка> Кв , сондықтан ертіндіде (5.24) тепе – теңдік басым жүреді:
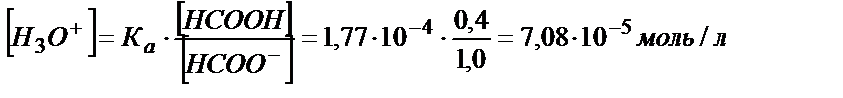
рН = 4,15.
Сол сияқты әлсіз негіз ертіндісінде, мысалы аммиак пен аммоний хлориді бар ертіндіде:
NН3 + Н2О ↔ NН4 ++ ОН- 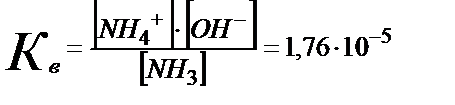 (5.25)
(5.25)
NН4+ + Н2О↔ NН3 +Н3О+
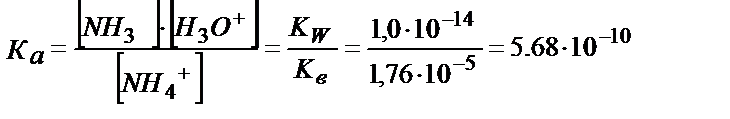
Кв > Ка, сондықтан ертіндіде басым жүретін тепе-теңдік (5.25). Ертіндінің қышқылдығы (5.25) теңдігінен анықталады:
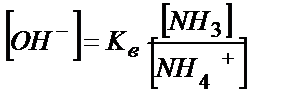 ; [NН3] = С NН3 ; [NН4 +] = С NН4СІ
; [NН3] = С NН3 ; [NН4 +] = С NН4СІ
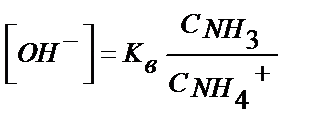 ;
; 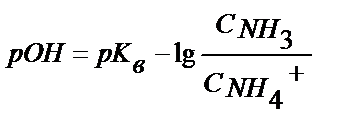 ;
;
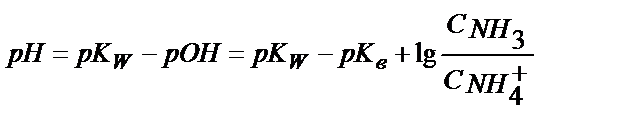 (5.26)
(5.26)
Мұндай қоспалардың ерітінділері буферлі ерітінділер деп аталады. Буферлі ерітінділердің рН-ы оларды сұйылтқанда, не аздап қышқыл мен негіз қосқанда іс жүзінде өзгермейді.
Буферлі ерітіндіні сұйылтқанда қоспаның құрамындағы компоненттердің концентрациялары бірдей өзгереді, сондықтан олардың қатынасы тұрақты болып қалады. (5.23, 5.26-теңдіктері).
Егер бұл ерітіндіге Н3О+ концентрациясын өзгертетін күшті қышқыл қоссақ (5.21) теңдігі бойынша НА концентрациясы көбейеді (СНА+[Н3О+]), ал А- концентрациясы азаяды (СА- – [Н3О+]). Бұл мәндерді (5.23) теңдікке қойсақ

Керісінше, күшті негіз құйсақ НА концентрациясы азайып, А- концентрациясы артады: (СНА-[ОН-]); (СА- + [ОН-]).
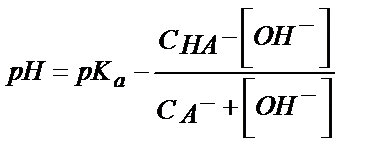
Мысалы, құрамында 0,1М СН3СООН және 0,1М СН3СООNa бар буферлі ерітіндінің рН осы ерітіндіге 0,01М НCl, 0,01М NaOH қосса былай өзгереді (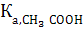 = 1,75∙10-5; рКа= 4,76):
= 1,75∙10-5; рКа= 4,76):
1) 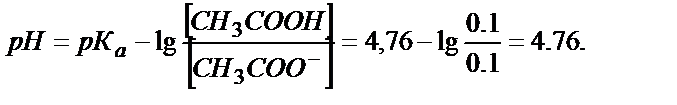
2) 0,01М НСl қосқаннан кейін:

Егер 0,01 М НСl- ды таза суға қосса ерітіндінің рН 7-ден 2-ге дейін өзгерер еді, ал буферлі қоспаның рН 0,09-ға ғана өзгереді.
1) 0,01М NaOH қосқанда:
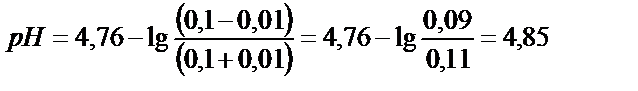
Буферлі қоспа аналитикалық химияда кең қолданылады. Буферлі қоспа буферлік сыйымдылық π деген мәнмен сипатталады, бұл 1 л ерітіндінің рН-ын бір бірлікке өзгертуге жеткілікті қышқыл мен сілтінің мөлшері (моль):
π = 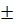 (∆С/∆рН)
(∆С/∆рН)
Ең жоғарғы буферлік сыйымдылық бар ерітінді бұл компоненттерінің қатынасы 1:1 тең ерітінді.
5.2.4. Көп негізді қышқылдар мен негіздердің ерітінділері
Көп негізді протолиттердің протолизі сатылай жүреді, мысалы:
H2S + H2O ↔ H3O+ + HS- ; Ка,1= 8,9∙10-8; рКа,1= 7,05
HS- + H2O ↔ H3O+ + S2- ; Ка,2= 1,3∙10-13; рКа,2= 12,89
СО 32- + H2O ↔ НСО3- + ОН-; Кв,1= KW /Kа,2 = 2∙10-4; рКв,1= 3,70
НСО3- + H2O ↔ Н2СО3 + ОН-; Кв,2= KW /Kа,1 = 2∙10-8; рКв,2= 7,70
Егер К1 мен К2 мәндерінде 1000 еседен артық айырмашылық болса (Ка,1/Ка,2 >1000, не Кв,1/Кв,2 > 1000) онда протолиз негізінде бірінші саты бойынша жүреді, келесі реакциялардың жүру дәрежесі өте төмен. Сондықтан келтірілген мысалдарда ерітіндінің рН (2.19) және (2.20) теңдіктерімен есептеледі.
Бөлме температурасында қаныққан ерітіндіде СH2S=10-1моль/л. Ерітіндінің рН анықтайтын теңдік:
H2S + H2O ↔ H3O+ + HS-
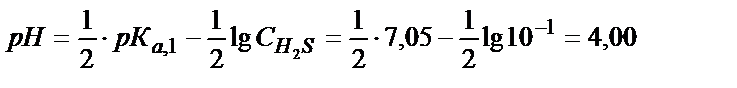
Na2CO3 ерітіндісіндегі рН анықтайтын реакция:
СО 32- + H2O ↔ НСО3- + ОН-
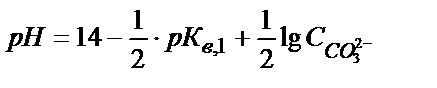
0,1 М Na2CO3 ерітіндісін алсақ:
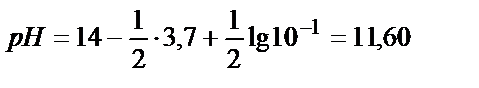
5.2.5. Амфолиттердің ерітінділері
Амфолитті электролиттерде екі түрлі тепе-теңдіктер орнайды
НА- + Н2О ↔ Н3О+ + А-, 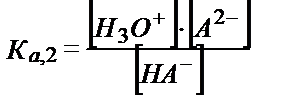 (5.27)
(5.27)
НА- + Н2О ↔ Н2А + ОН-, 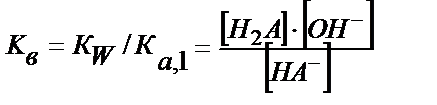
не НА- + Н3О+ ↔ Н2А + Н2О, 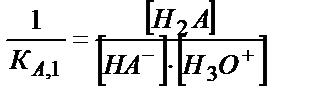 (5.28)
(5.28)
Келтірілген (5.27, 5.28) теңдіктерден ерітіндідегі гидроксоний ионының концентрациясы:
[H3O+] = [A2-] – [H2A] (5.29)
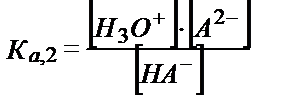 теңдігінен
теңдігінен 
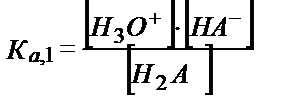 теңдігінен
теңдігінен 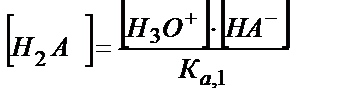
[A2-] және [H2A] мәндерін (5.29) теңдігіне қойсақ:
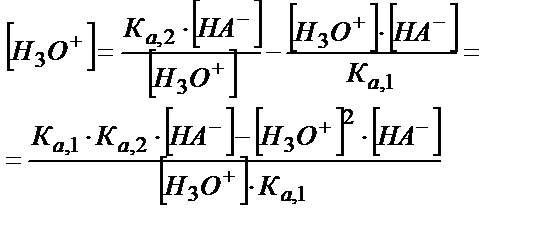
[H3O+]2 ∙ Ка, 1 + [H3O+]2 ∙ [HA-]=Kа,1 ∙ Kа,2 [HA-]
[H3O+]2 ∙ (Ка, 1 + [HA-]) = Kа,1 ∙ Kа,2 ∙ [HA-]
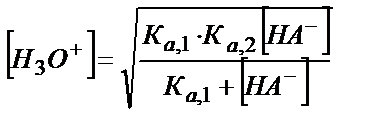 (5.30)
(5.30)
Жиі Ка,1 мәні [HA-] концентрацясына қарағанда аз болады, сондықтан Ка,1 еске алмаса да болады, онда (5.30) теңдігі қарапайым күйге келеді:
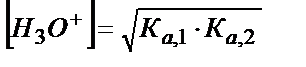 (5.31)
(5.31)
(5.27), (5.28) теңдіктерінен басқа судың автопротолиздену тендігін де еске алсақ:
2 Н2О ↔ Н3О++ ОН-
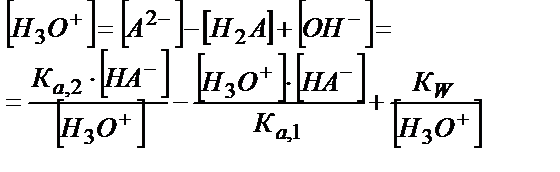
[H3O+]2 ∙ Ка, 1 + [H3О+]2 ∙[HA-] = Kа,2 ∙ Kа,1 ∙[HA-] + К а,1∙ КW
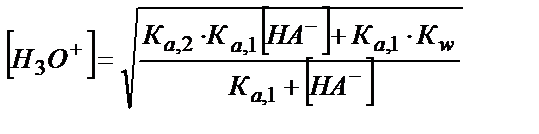 (5.32)
(5.32)
Егер Ка,1∙ КW < Kа,2 ∙ Kа,1 ∙[HA-] және Ка, 1 аз мән болса:
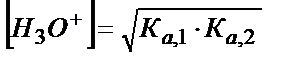 ;
; 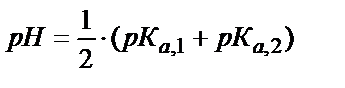
Мысалға төмендегі ерітінділердің рН табайық:
1) 0,1 М NaHCO3, Kа,1 =4,45∙10-7; Kа,2=4,7∙10-11
Kа,1< 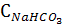
 рН=8,30.
рН=8,30.
2) 0,001 М Na2HРO4
Құрамында HРO42- аниондары бар Kа,2 және Kа,3 константаларын (Kа,2 = 6,34∙10-8, Kа,3=4,2∙10-13) және (5.32) теңдігін пайдалансақ:
Kа,2 ∙ Kа,3∙ [HРO42-] =6,34∙10-8∙4,2∙10-13·10-3=3∙10-23
Kа,2 ∙ КW = 6,34∙10-8∙10-14 = 6,3∙10-22
Kа,2<  , 6,34∙10-8 < 10-3
, 6,34∙10-8 < 10-3
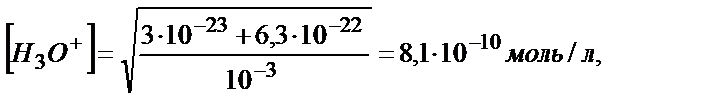 рН = 9,10
рН = 9,10
Ал, (5.31) теңдігін пайдалансақ:
 , рН= 9,80.
, рН= 9,80.
3) 0,01М NaH2РO4 ,
Құрамында H2РO42- аниондары бар Kа,1 және Kа,2 константаларын пайдаланамыз:
Kа,1 =7,11∙10-3; Kа,2=6,34∙10-8; С NaH2РO4=10-2М.
Kа,1 ∙ Kа,2∙ С NaH2РO4= 7,11∙10-3 ∙6,34∙10-8 ∙10-2=4,5∙10-11
4,5∙10-11> Kа,1 ∙ КW = 7,11∙10-3∙10-14= 7,11∙10-17
(5.32) теңдігін пайдалансақ:
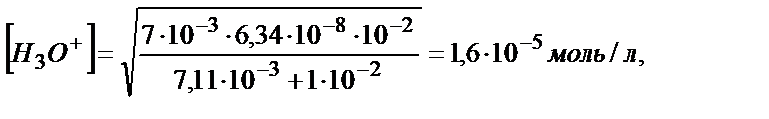 рН=4,80.
рН=4,80.
(5.31) теңдігін пайдалансақ:
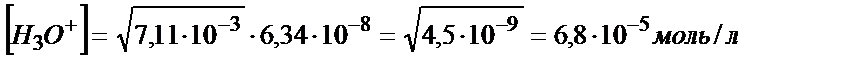 рН=4,20.
рН=4,20.
Әлсіз екі және үш негізді қышқылдар мен олардың тұздарынан буферлі ерітінділер дайындауға болады:
1) Н2А және онымен қосарласқан негіз NaHA: Н3А-NaH2A
Н2А +Н2О ↔ Н3О++ НA-
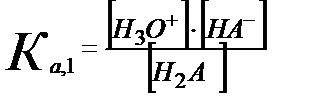 ;
; 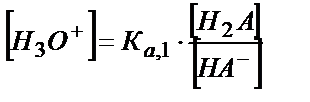
2) NaHA қышқылы және онымен қатарласқан негіз Na2A:
НA-+Н2О ↔ Н3О++ А2-
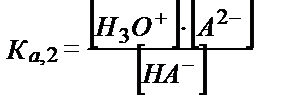 ;
; 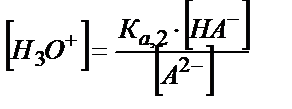
3) Na2HA қышқыл және онымен қатарласқан негіз Na3A:
НA2-+Н2О ↔ Н3О++ А3-
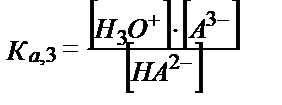 ;
; 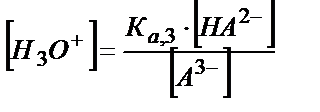
Келтірілген теңдіктерді пайдалану үшін қышқыл мен қосарласқан негіздің концентрациялары үлкен және қышқылдың протолизінің әр сатысына сәйкес константаларының арасында айырмашылықтар көп болу керек.
5.3. Ерітінділер құрамының рН-қа тәуелділігі
Көп жағдайда ерітіндідегі компоненттердің белгілі рН-қа сәйкес концентрацияларын білу қажет, ол үшін әр компоненттің молдік үлесін (α) табады. Ең қарапайым қышқыл-негіздік жүйені қарастырайық:
НА + Н2О ↔ Н3О+ + А-, 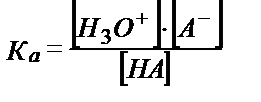 (5.33)
(5.33)
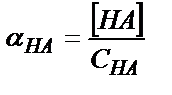 ;
; 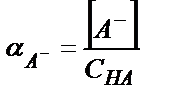
Осы жүйеге байланысты материалдық балланс теңдігі:
СНА = [HA] +[A-], (2.33) теңдіктен [A-] = KA ∙ [HA]/ [H3O+]
СНА = [HA] + KA ∙ [HA]/ [H3O+] = [HA] (1+ KA ∙ / [H3O+])


αA- табу үшін (2.33) теңдіктен [HA] =[H3O+] [A-] / KA
СНА = [H3O+] [A-] / KA + [A-] = [A-] ∙ ([H3O+] /KA +1)
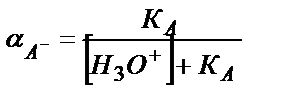 ,
,
Егер екі негізді қышқыл мен оның аниондары бар жүйені қарастырсақ материалдық балланс бойынша:
С H2А = [H2A] +[НA-]+[A2-] (5.34)
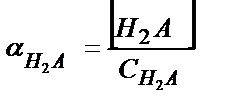 ;
; 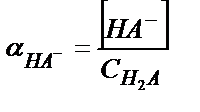 ;
; 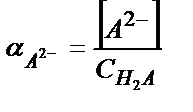
Н2А қышқылының сатылай протолиздену константаларынан:
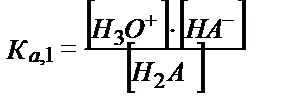 (5.35)
(5.35)
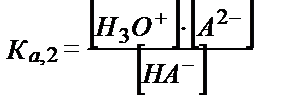 (5.36)
(5.36)
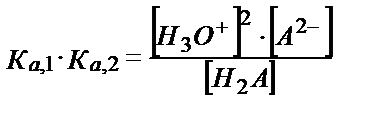 (5.37)
(5.37)
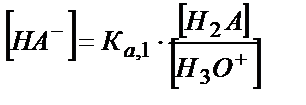 ;
; 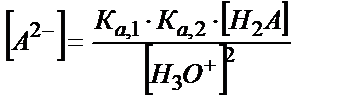
[НA-] мен [A2-] мәндерін материалдық балланс теңдігіне қойсақ
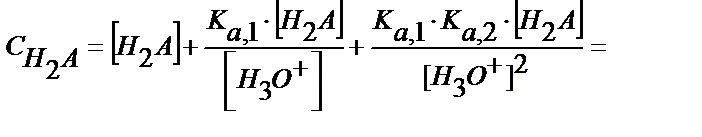
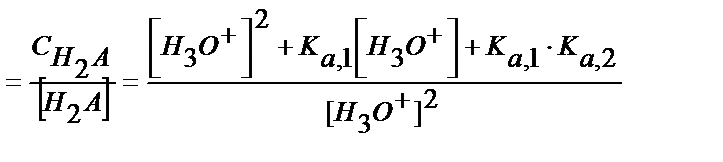
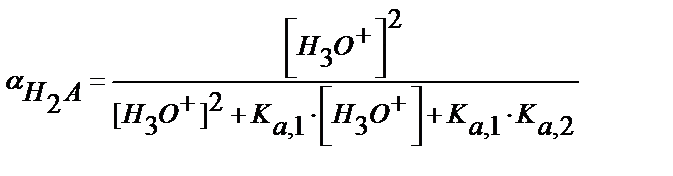 (5.38)
(5.38)
Осы сияқты αНА- табу үшін (5.35), (5.36) теңдіктерден:
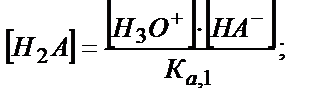
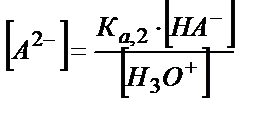
Табылған мәндерді материалдық балланс теңдігіне қойсақ:
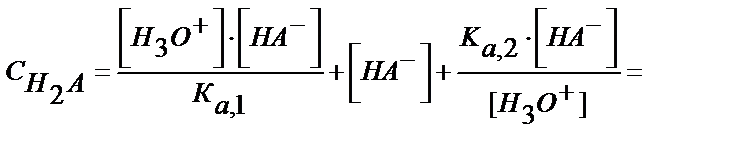
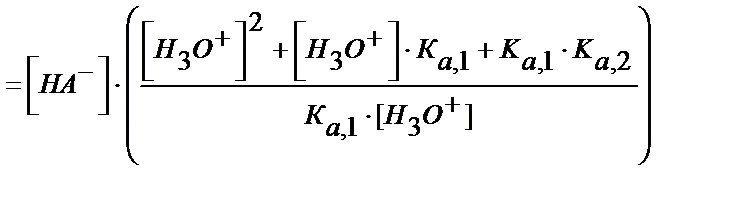
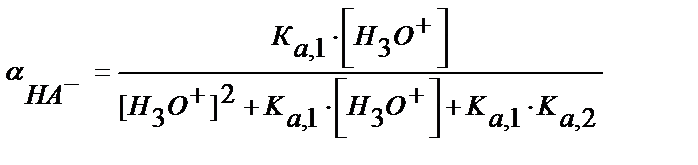 (5.39)
(5.39)
αА2- табу үшін (5.3), (5.37) теңдіктерден:
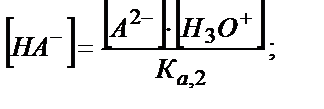

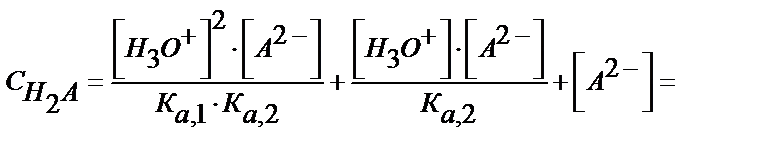
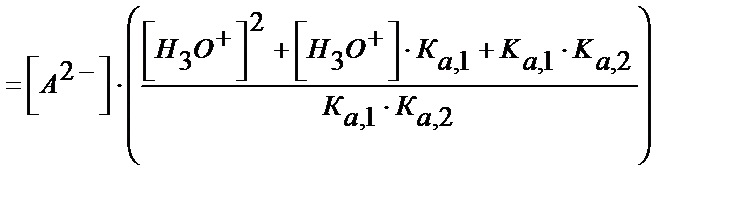
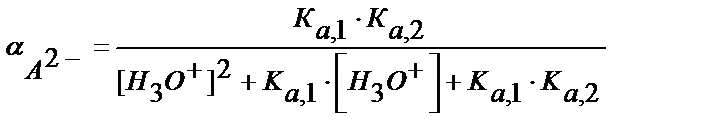 (5.40)
(5.40)
Еске алатын бір жәй әр бөлшектің мольдік үлесіне сәйкес теңдіктердің (5.38-5.40) бөлімі бірдей және олардың мәні қышқылдың жалпы концентрациясына (С H2А) тәуелді емес. Кез келген жүйеде α бар мәндердің қосындысы бірге тең (α H2А +α НА- + αА2- =1).
| Н2S |
| S2- |
| 0,2 |
| 0,4 |
| 0,6 |
| 0,8 |
| 10 14 |
| рН |
| α |
| НS- |
| Н3С2О4 |
| С2О42- |
| 0,2 |
| 0,4 |
| 0,6 |
| 0,8 |
| 6рН |
| α |
| Н2С2О4- |
| 5.1-сурет. Қымыздық қышқылының ерітісіндегі бөлшектердің мольдік үлесінің ерітінді рН-на тәуелділігі | 5.2-cурет. Күкіртті сутегі қышқылының ерітісіндегі бөлшектердің мольдік үлесінің ерітінді рН-на тәуелділігі |
Үш және төрт негізді қышқылдар ерітінділеріндегі компоненттердің мольдік үлесін есептеу жоғарыда келтірілген мысалдарға ұқсас:
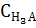 = [H3A] +[Н2A-] + [НA2-] +[A3-]
= [H3A] +[Н2A-] + [НA2-] +[A3-]
 ; (5.41)
; (5.41)
 ; (5.42)
; (5.42)
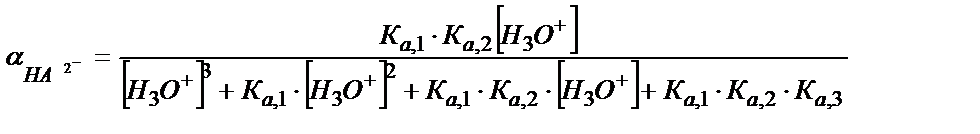 ; (5.43)
; (5.43)
 ; (5.44)
; (5.44)
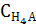 = [H4A] +[Н3A-] + [Н2A2-] +[НA3-] +[A4-]
= [H4A] +[Н3A-] + [Н2A2-] +[НA3-] +[A4-]
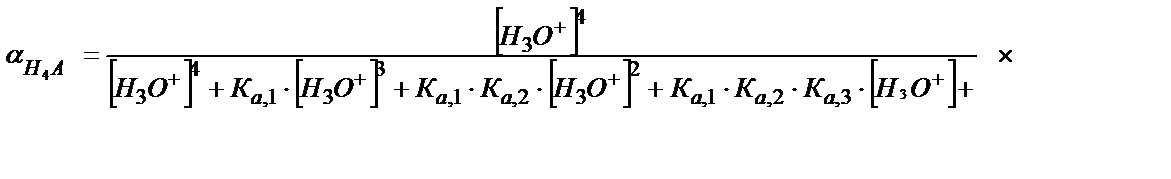
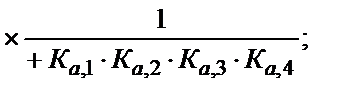 (5.45)
(5.45)
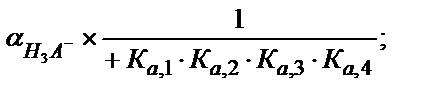 (5.46)
(5.46)
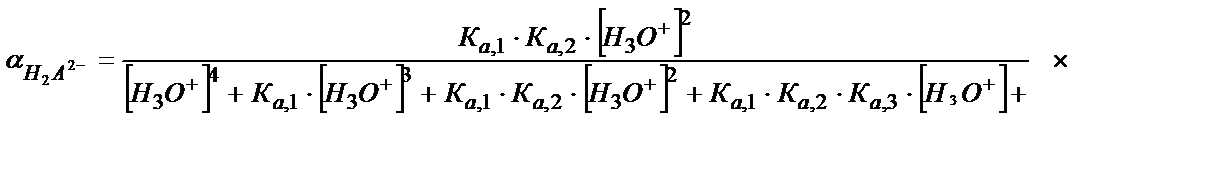
 (5.47)
(5.47)
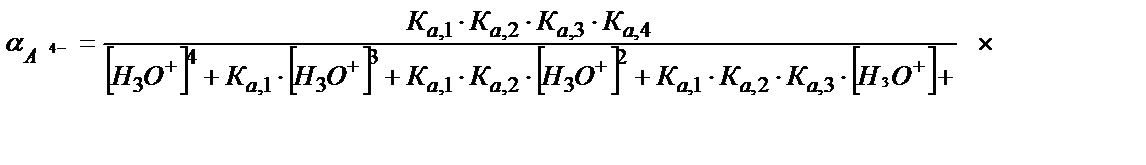
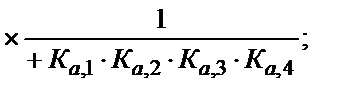 (5.48)
(5.48)
5.3-сурет. Фосфор қышқылының ерітіндісіндегі бөлшектердің мольдік үлесінің ерітінді рН-на тәуелділігі.
|
5.4-cурет. Этилендиаминтетрасірке қышқылының ерітіндісіндегі бөлшектердің мольдік үлесінің ерітінді рН-на тәуелділігі. Ка,1=10-2; Ка,2=1,8·10-3, Ка,3=6,9·10-7, Kа,4=5,5·10-11. |
Келтірілген мәліметтерден Н2А протолизденгенде пайда болатын бөлшектердің үлесі ерітінді рН-на және сатылай протолиздену константасының мәндеріне байланысты. Мысалы, қымыздық қышқылы (Ка,1=5,6∙10-2; Ка,2=5,4∙10-5) мен күкіртті сутегі қышқылының (Ка,1=8,9∙10-6; Ка,2=1,3∙10-13) тепе-теңдік диаграммаларынан оксалат-ионының (С2О42-) үлесі рН 7,0-де бірдің шамасында, ал осы рН-та сульфид-ионының (S2-) үлесі 5∙10-7, тек рН 12 кеткенде α(S2-) = 0,1, ал рН = 13-те 0,5 сәйкес.
Бақылау сұрақтары мен жаттығулар:
1. Бренстед-Лоури теориясы тұрғысында қышқылдардың, негіздердің және амфолиттердің анықтамасын беріңдер.
2. Қосарласқан қышқыл мен негіз жұбының протолиздену константалары қалай байланысқан? Сәйкес формуланы қорытып шығарыңдар.
3. Судың, сұйық аммиактың, сусыз сірке қышқылының автопротолиздену теңдіктерін жазыңыз.
4. Бренстед-Лоури теориясы тұрғысынан гидролиз құбылысын сипаттаңыз.
5. Буферлі қоспалардың мысалдарын келтіріңдер. Буферлі қоспаның рН-ы оған қышқыл не негіз қосқанда өзгермейді десе болады, неге?
1. HNO2 ерітіндісіндегі H+- иондары концентрациясын есептеуде қандай теңдеуді пайдалануға болады?
1) 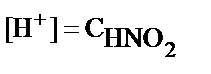 ; 2)
; 2) 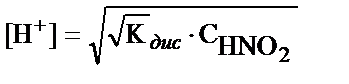 ; 3)
; 3) 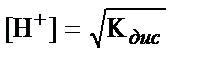 ;
;
4) 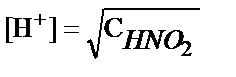 ; 5)
; 5) 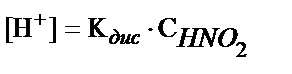 .
.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1530; Нарушение авторских прав?; Мы поможем в написании вашей работы!