
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тест тапсырмалары 1 страница. Қышқыл-негіздік титрлеу
|
|
|
|
Тарау
Қышқыл-негіздік титрлеу
6.1. Қышқыл-негіздік титрлеудің мәні
Қышқылды-негіздік титрлеу қышқылдар мен негіздердің арасындағы реакцияларға негізделген.
 , не
, не 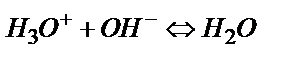
Пайдаланатын титрантка байланысты бұл әдісті алкалиметрия (титрант-негіз) және ацидиметриялық (титрант-қышқыл) титрлеу деп екіге бөлуге болады.
Ацидиметриялық титреу күшті, әлсіз негіздерді, негіздік тұздарды, негіздік қасиет көрсететін әлсіз қышқылдардың тұздарын т.б. анықтауға қолданылады. Алкалиметриялық титрлеумен күшті және әлсіз қышқылдарды, қышқыл тұздарды, қышқылдық қасиет көрсететін әлсіз негіздердің тұздарын т.б. анықтайды.
Протолиттік реакциялар титриметриялық анализде пайдалынатын реакцияларға қойылатын шарттарға толық жауап береді. Реакция жылдам, белгілі стехиометриялық қатынаста жүреді. Қышқылды не негізді титрлегенде Ка және Кв мәніне байланысты реакция аяғына дейін жүретін жағдайды жеңіл жасауға болады. Ал эквиваленттік нүктені анықтауға жиі қышқылды-негіздік индикаторлар пайдаланылады, сонымен қатар кейбір физика-химиялық әдістерді де пайдалануға болады – потенциометрия, кондуктометрия, амперометрия, фотометрия т.б.
6.2. Қышқыл-негіздік индикаторлар
Қышқылды-негіздік индикаторлар – суда әлсіз протолиттік қасиет көрсететін органикалық қышқылдар HInd мен негіздер Ind.
Қышқылдық индикаторлар:
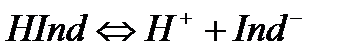
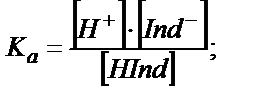
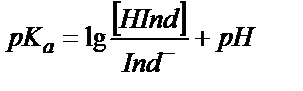 (6.1)
(6.1)
Негіздік индикаторлар:
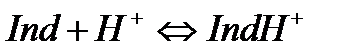
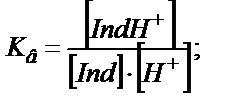
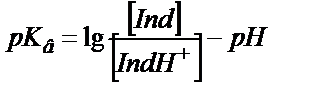 (6.2)
(6.2)
рКа, рКв – индикатордың қышқылдық және негіздік константаларының көрсеткіштері.
Индикатордың ионизацияланбаған түрінің түсі мен ион түрінде жүретін бөлшектерінің түсінің арасында айырмашылық болады.
Егер 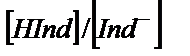 қатынасы бірге тең болса
қатынасы бірге тең болса
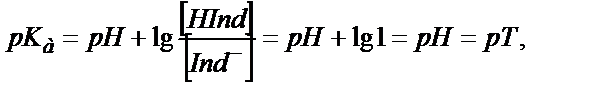
 онда
онда
рН=pKинд тең индикатордың көрсеткішін титрлеу көрсеткіші (рТ) деп белгілейді. Бұл нүктеде индикатордың 50 % қышқылдық, 50 % негіздік түрінде жүреді, яғни титрлеу көрсеткіші индикатордың екі түрінің концентрациясы бір-біріне тең жағдайға сәйкес рН- пен анықталады. Әдетте адамның көзі екі боялған заттың қоспасынан жуық мәнмен 10 есе артық мөлшерде жүрген түрінің бояуын көреді. Егер 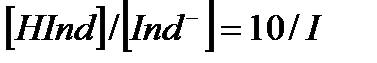 болса ерітіндінің бояуы индикатордың қышқылдық түрінің түсіне сәйкес болады, ал
болса ерітіндінің бояуы индикатордың қышқылдық түрінің түсіне сәйкес болады, ал 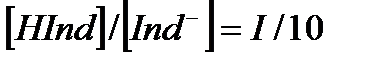 болса, онда ол индикатордың негіздік түрінің түсіне сәйкес болады. (6.1) теңдігінен:
болса, онда ол индикатордың негіздік түрінің түсіне сәйкес болады. (6.1) теңдігінен:
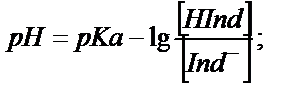
 болғанда
болғанда 
Индикатор өзінің түсін 
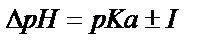 аралығында өзгертеді. Бұл рН аралығын индикатордың түсін ауыстыру аралығы деп атайды. 6.1. кестеде жиі пайдаланылатын индикаторлардың сипаттамалары келтірілген.
аралығында өзгертеді. Бұл рН аралығын индикатордың түсін ауыстыру аралығы деп атайды. 6.1. кестеде жиі пайдаланылатын индикаторлардың сипаттамалары келтірілген.
6.1. – кесте
| Индикатор | 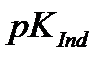
| Түсі ауысу аралығы | рТ | Түсі | |
| Қышқылды түрі | Негіздік түрі | ||||
| Метилді сары | 3,1 | 2,7 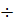 4,0 4,0
| 3,0 | қызыл | сары |
| Метилоранж | 3,5 | 3,2 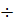 4,4 4,4
| 4,0 | қызыл | сары |
| Метилді қызыл | 5,0 | 4,2 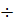 6,2 6,2
| 5,5 | қызыл | сары |
| Фенолды қызыл | 8,0 | 6,8 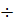 8,2 8,2
| 7,5 | сары | қызыл |
| Фенолфталеин | 8,7 | 8,0 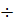 9,8 9,8
| 9,0 | түссіз | күлгін-қызыл |
Индикаторлардың түсінің өзгеруі олардың құрамындағы бір хромофорлы топшаның екінші хромофорлы топшаға айналуында. Мысалы, метилоранж индикаторының сілтілік ортадағы құрамы:

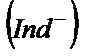
Бұл қосылыстың бояуы хромофорлы азотопшасына (–N=N–) байланысты. Протонды қосып алғанда, яғни негіздік түрінен қышқылды түріне ауысқанда хромофорлы хиноидты топша пайда болады:

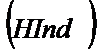
Не фенолфталеин индикаторының түссіз қышқылдық түрінен боялған негіздік түріне ауысуы жаңа хромофорлы, көрінетін жарықтың спектрлерін жұтатын хиноидты топшаның пайда болуында:
| О |

Кей жағдайда бір индикатордың орнына екі индикатордың қоспасын, не индикатор мен бояғыштың қоспасын алған тиімді. Мысалы, метилоранж бен индигокармин қоспасы ерітіндінің рН 4 болғанда сұр түсті, бұдан қышқылдау ортада ол күлгін түске ауысады. Мұндай индикаторды дайындау үшін 1 г метилоранжды 2,5 г индигокарминмен араластырып 1 л суда ерітеді.
Қышқылды-негіздік индикаторлар мынандай шарттарға жауап берулері керек: олар сезімтал, екі түрі ашық боялған, бояуының ауысу аралығы кішкентай, екі түрінің арасындағы тепе-теңдік тез орнайтын болуы керек.
6.3. Қышқыл-негіздік титрлеу қисықтары
Титриметриялық әдісте таңдап алған реакцияларды титриметриялық анализде пайдалануға бола ма, болса эквивалентті нүктені анықтауға қандай индикатор сәйкес келеді деген сұрақтарға жауап беру үшін құйылған титранттың көлеміне байланысты ерітіндінің рН-ның өзгеруін көрсететін титрлеу қисығын құру қажет. Кей жағдайда титрлеу қисығын математикалық өңдеу керек болса, абцисса өсіне титрант көлемінің (VR) орнына бұл көлемнің құрамында реагенттің стехиометриялық мөлшері бар көлемге (VP,стех.) қатынасын алған жөн – 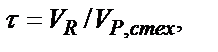 τ – титрлену дәрежесі.
τ – титрлену дәрежесі.
Титрлеу қисығын құру үшін ерітіндінің эквивалентті нүктеге дейінгі, эквивалентті нүктедегі және эквивалентті нүктеден кейінгі рН мәндері есептеледі.
6.4. Күшті қышқылды күшті негізбен титрлеу
10,00 мл 0,100 М тұз қышқылын 0,100 М натрий гидроксидімен титрлеуін қарастырайық. Эквивалентті нүктеге дейінгі ерітіндінің рН -ы, тұз қышқылы судағы ерітіндісінде түгел протонизацияланатындықтан, тирленбей қалған бос қышқылдың аналитикалық концентрациясымен анықталады. Титрлегенге дейін 0,100 М HCl – ға сәйкес:
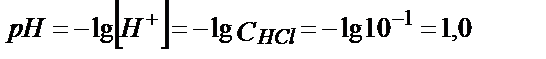
Титрлей бастағанда эквивалентті нүктеге дейін тұз қышқылының бос концентрациясы, оған сәйкес сутегі ионының концентрациясы былай анықталады:
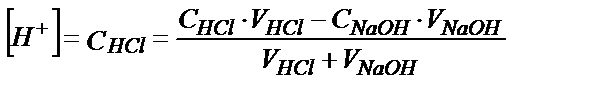
не жалпы түрде:
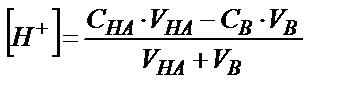
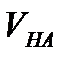 - титрлеуге алынған қышқылдың көлемі;
- титрлеуге алынған қышқылдың көлемі; 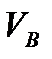 – құйылған негіздің көлемі;
– құйылған негіздің көлемі; 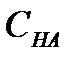 және
және 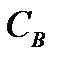 – қышқыл мен негіздің эквивалентінің молярлы концентрациясы. Мысалы, 10,00 мл 0,100 М HCl – ға 9,00 мл 0,100М NaOH-ты қоссақ:
– қышқыл мен негіздің эквивалентінің молярлы концентрациясы. Мысалы, 10,00 мл 0,100 М HCl – ға 9,00 мл 0,100М NaOH-ты қоссақ:
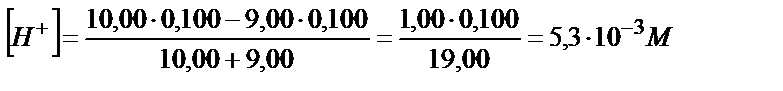
Эквивалентті нүктеде 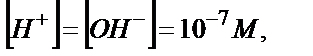 ал рН=7,0.
ал рН=7,0.
Эквивалентті нүктеден кейін, негіздің артық мөлшері құйылғандықтан, ерітіндінің рН-ы артық құйылған негіздің бос концентрациясымен анықталады:
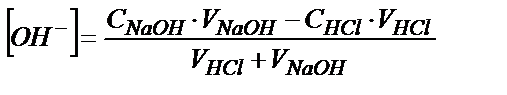
жалпы түрде:

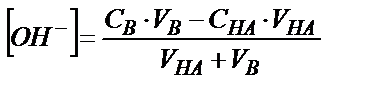
ал 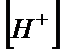 мәні судың иондық көбейтіндісіннен Kw=
мәні судың иондық көбейтіндісіннен Kw= 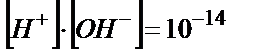 табылады:
табылады: 
Алынған қышқылды тирлеу нәтижесі 6.2 кестеде келтірілген.
6.2 – кесте
10 ,00 мл 0,100 М HCl ерітіндісін 0,100 М NaOH ерітіндісімен титрлеу нәтижелері
| VB(NaOH), мл | 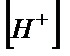
| pH | 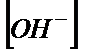
| pOH |
| 0,00 | 1,0·10-1 | 1,00 | 1·10-13 | 13,0 |
| 5,00 | 3,3·10-2 | 1,5 | 3,0·10-13 | 12,5 |
| 9,00 | 5,3·10-3 | 2,3 | 1,9·10-12 | 11,7 |
| 9,90 | 5,0·10-4 | 3,3 | 2,0·10-11 | 10,7 |
| 9,99 | 5,0·10-5 | 4,3 | 2,0·10-10 | 9,7 |
| 10,00 | 1,0·10-7 | 7,0 | 1,0·10-7 | 7,0 |
| 10,01 | 2,0·10-10 | 9,7 | 5,0·10-5 | 4,3 |
| 10,10 | 2,0·10-11 | 10,7 | 5,0·10-4 | 3,3 |
| 11,00 | 2,1·10-12 | 11,7 | 4,8·10-3 | 2,3 |
| VNaOH, Mл |
| pH |
| 6.1 – сурет. 1-10,00 мл 0,100 М HCl ерітіндісін 0,100 М NaOH ерітіндісімен, 2-10,00 мл 0,010 М НCl ерітіндісін 0,100 М NaOH ерітіндісімен титрлеу қисықтары. |
Келтірілген нәтижелерден (6.2 – кесте, 6.1 – сурет) ерітіндінің рН тек эквиваленттік нүкте тұсында күрт өзгереді, ал бұл нүктеге дейін және одан кейін рН мәнінің өзгеруі өте баяу. рН – тың 4,3 тен 9,7 ге күрт өзгеруі (1-қисық) құйылған натрий гидроксидінің 9,99 мл 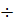 10,01 мл көлемі аралығында жатыр, яғни титрлеу қисығының эквивалентті бөлігінде жатыр. Сондықтан эквивалентті нүктені анықтауға рТ мәні келтірілген рН аралығында жатқан кез-келген индикаторларды пайдалануға болады. Олар – метилоранж (рТ=4), метилді қызыл (рТ=5,5), фенолды қызыл (рТ=7,5), фенолфталеин (рТ=9,0). 6.1 – суретте көрсетілгендей, егер сұйытылған ерітінділер пайдаланылса (2-қисық) титрлеу қисығының эквивалентті бөлігі кішірейеді. 0,010 М HCl ерітіндісін 0,010 М NaOH ерітіндісімен титрлегенде эквиваленттік бөлік рН –тың 5,3 пен 8,7 мәндерінің аралығында жатыр, бұл жағдайда индикатор ретінде метилоранжды пайдалануға болмайды. Күшті протолиттерді, егер олардың концентрациясы 0,001 М – ден кіші болса, титрлеу мүмкін емес, себебі титрлеу қисығында эквивалентті бөлікті байқау қиын болады.
10,01 мл көлемі аралығында жатыр, яғни титрлеу қисығының эквивалентті бөлігінде жатыр. Сондықтан эквивалентті нүктені анықтауға рТ мәні келтірілген рН аралығында жатқан кез-келген индикаторларды пайдалануға болады. Олар – метилоранж (рТ=4), метилді қызыл (рТ=5,5), фенолды қызыл (рТ=7,5), фенолфталеин (рТ=9,0). 6.1 – суретте көрсетілгендей, егер сұйытылған ерітінділер пайдаланылса (2-қисық) титрлеу қисығының эквивалентті бөлігі кішірейеді. 0,010 М HCl ерітіндісін 0,010 М NaOH ерітіндісімен титрлегенде эквиваленттік бөлік рН –тың 5,3 пен 8,7 мәндерінің аралығында жатыр, бұл жағдайда индикатор ретінде метилоранжды пайдалануға болмайды. Күшті протолиттерді, егер олардың концентрациясы 0,001 М – ден кіші болса, титрлеу мүмкін емес, себебі титрлеу қисығында эквивалентті бөлікті байқау қиын болады.
6.5. Әлсіз қышқылды күшті негізбен титрлеу
10,00 мл 0,100 М CH3COOH ерітіндісін 0,100 М NaOH ерітіндісімен титрлеуді қарастырайық. Сірке қышқылы әлсіз қышқыл болғандықтан оның протолиздену реакциясы 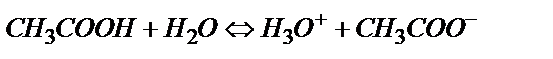 аз мөлшерде жүреді.
аз мөлшерде жүреді.
Қарапайым түрде
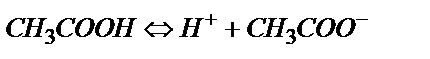
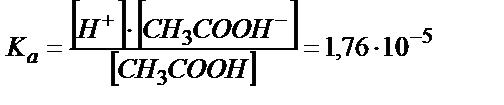 (6.3)
(6.3)
Ка мәні аз болғандықтан 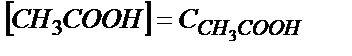 деп алуға болады;
деп алуға болады; 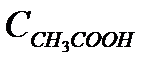 – сірке қышқылының жалпы концентрациясы (6.3) – теңдіктен
– сірке қышқылының жалпы концентрациясы (6.3) – теңдіктен 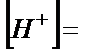
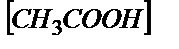
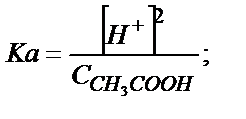
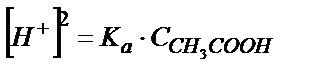 ;
; 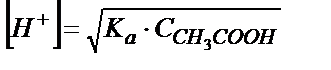
Осыдан 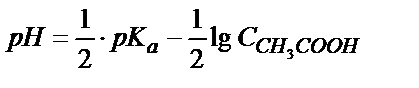 . Титрлегенге дейін 0,100М сірке қышқылының
. Титрлегенге дейін 0,100М сірке қышқылының 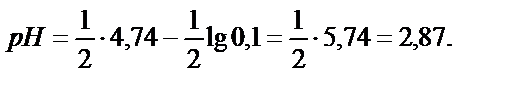
Титрлей бастағанда эквивалентті нүктеге дейін ерітіндіде бос қышқылмен қатар реакцияласу нәтижесінде пайда болған осы қышқылдың тұзы жүреді. Мысалы, 10,00 мл 0,100 М сірке қышқылына 9,0 мл 0,100 М NaOH ерітіндісін қоссақ 1,00 мл 0,100 М 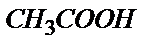 реакцияласпай қалады да, реакция нәтижесінде 9,00 мл 0,100 М
реакцияласпай қалады да, реакция нәтижесінде 9,00 мл 0,100 М 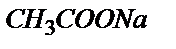 пайда болады. Бұл жағдайда
пайда болады. Бұл жағдайда 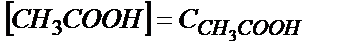 және
және 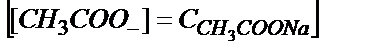 деп алуға болады, себебі (6.3) теңдік бойынша ерітіндіде СН3СОО- көп болса, реакция түгел солға қарай ығысады.
деп алуға болады, себебі (6.3) теңдік бойынша ерітіндіде СН3СОО- көп болса, реакция түгел солға қарай ығысады.
Сірке қышқылының қышқылдық константасынан:
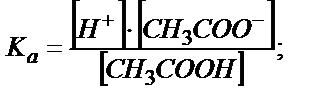
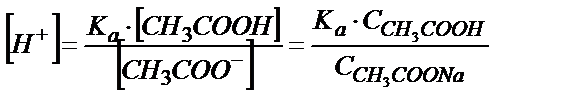
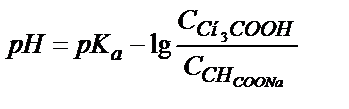 ;
; 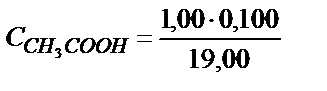
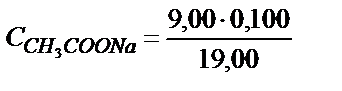 ;
; 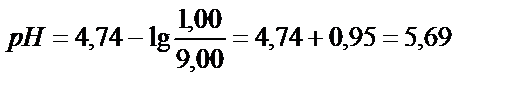
Эквивалентті нүктеде ерітіндіде концентрациясы қышқылдың концентрациясына тең тек 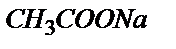 тұзы жүреді (0,100 М).
тұзы жүреді (0,100 М). 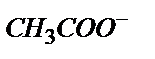 әлсіз негіз болғандықтан
әлсіз негіз болғандықтан
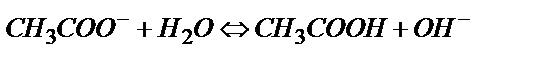 (6.4)
(6.4)
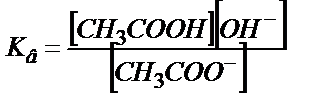 және (6.4) теңдігінен
және (6.4) теңдігінен 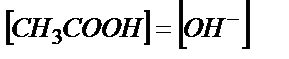
Қатарласқан қышқыл мен негіздің константаларының көбейтіндісі судың иодық көбейтіндісіне тең екенін еске алсақ:
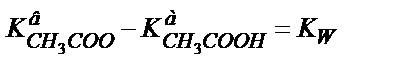
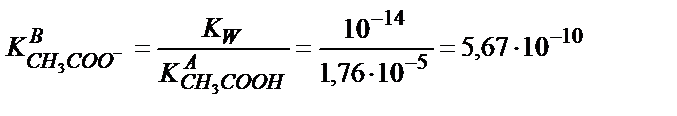 сандық мәнін табуға болады, осыдан:
сандық мәнін табуға болады, осыдан:
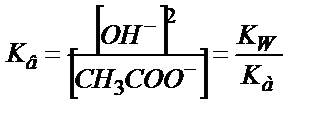 ;
; 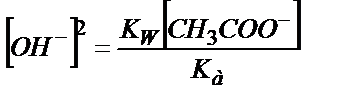 ;
;
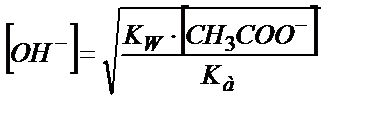 ;
;
КВ мәні өте аз болғандықтан 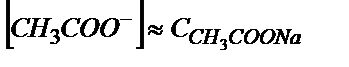 деп алуға болады. Онда
деп алуға болады. Онда
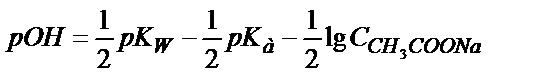 ;
;
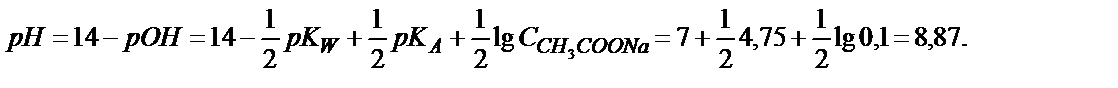
Эквивалентті нүктеден кейін ерітіндіде NaOH-тың артық мөлшері пайда болады да, ерітіндінің рН-ы бос жүрген NaOH мөлшерімен анықталады. 10,0 мл 0,100 М сірке қышқыл ерітіндісіне 10,01 мл 0,100 М NaOH құйсақ, 0,01 мл 0,100 М NaOH артық қалады:
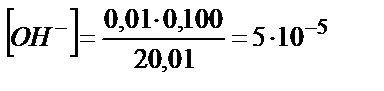 ; рОН=4,3; рН=14-рОН=14-4,3=9,70
; рОН=4,3; рН=14-рОН=14-4,3=9,70
6.3 – кесте
10,00 мл 0,100 М 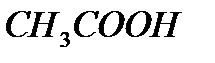 ерітіндісін 0,100 М NaOH ерітіндісімен титрлеу нәтижесі
ерітіндісін 0,100 М NaOH ерітіндісімен титрлеу нәтижесі
| VNaOH, мл | 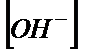
| pOH | 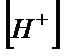
| pH |
| 0,00 | 7,4·10-12 | 11,13 | 1,35·10-3 | 2,87 |
| 5,00 | 5,5·10-10 | 9,26 | 1,82·10-5 | 4,74 |
| 9,00 | 5,0·10-9 | 8,30 | 2,00·10-6 | 5,70 |
| 9,90 | 5,5·10-8 | 7,26 | 1,82·10-7 | 6,74 |
| 9,99 | 5,5·10-7 | 6,26 | 1,82·10-8 | 7,74 |
| 10,00 | 7,4·10-6 | 5,13 | 1,35·10-9 | 8,87 |
| 10,01 | 5,0·10-5 | 4,30 | 2,00·10-10 | 9,70 |
| 10,10 | 5,0·10-4 | 3,30 | 2,00·10-11 | 10,70 |
| 11,00 | 5,0·10-3 | 2,30 | 2,00·10-12 | 11,70 |
Келтірілген кесте мен суреттен бұл титрлеу қисығының эквивалентті нүктесі ерітіндінің рН 7- ден жоғары бөлігінде жатыр. Сондықтан бұл жағдайда эквивалентті нүктені анықтауға индикатор ретінде рТ=9 тең фенолфталеинді қолдануға болады.
6.3 – суретте көрсетілгендей эквивалентті бөліктің мәні қышқылдың аналитикалық концентрациясымен қатар протолиздену константасы Ка – мен де анықталады. Ка мәні 1·10-8 тең қышқылды титрлегенде қисықтың эквивалентті нүктесін анықтау қиындыққа әкеп соғады. Осыдан индикаторды пайдаланып эквивалентті нүктені анықтау үшін мынандай жағдай орындалуы керек: 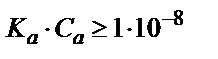
|
6.2-сурет. 10,00 мл 0,100 М 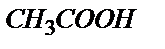 ерітіндісін 0,100 М NaOH ерітіндісімен титрлеу қисығы ерітіндісін 0,100 М NaOH ерітіндісімен титрлеу қисығы
| ||||||||||||||||||||
| 6.3-сурет. Ка мәні әртүрлі 10,00 мл 0,100 М НА ерітіндісін 0,100 М NaOH ерітіндісімен титрлеу қисықтары |
6.6. Әлсіз негізді күшті қышқылмен титрлеу
10,00 мл 0,100 М 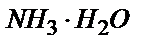 ерітіндісін (
ерітіндісін (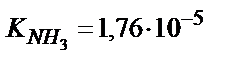 ; рКв=4,76) 0,100 М HCl ерітіндісімен титрлеу.
; рКв=4,76) 0,100 М HCl ерітіндісімен титрлеу.
Әлсіз негізді титрлегенде рН-ты есептейтін теңдіктер әлсіз қышқылды титрлегендегідей қорытылып шығарылады.
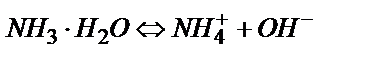
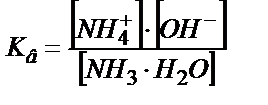 ;
; 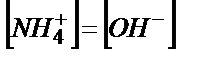 ;
; 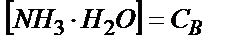
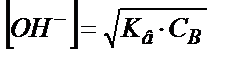 ;
; 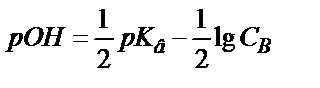 , бұдан
, бұдан 

10,00 мл 0,100 М 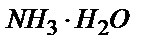 ерітіндісіне 9,00 мл 0,100 М HCl ерітіндісін қоссақ, нәтижесінде 9,00 мл 0,100М NH4Cl ерітіндісі пайда болады да, бос күйінде 1,00мл 0,100 М
ерітіндісіне 9,00 мл 0,100 М HCl ерітіндісін қоссақ, нәтижесінде 9,00 мл 0,100М NH4Cl ерітіндісі пайда болады да, бос күйінде 1,00мл 0,100 М 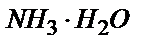 қалады:
қалады:
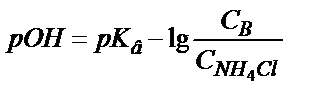 ;
; 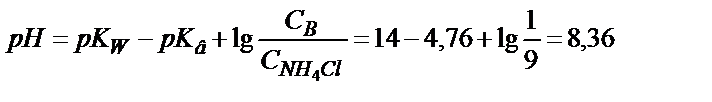
Эквивалентті нүктеде тек 0,100 М NH4Cl тұзының ерітіндісі пайда болады:
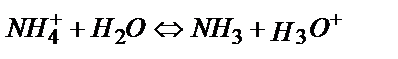
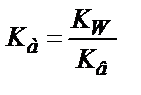 ;
; 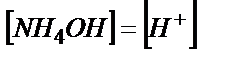 ;
; 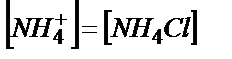 ;
;
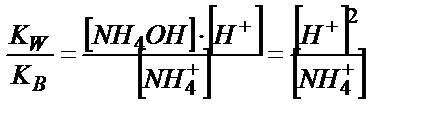 ;
; 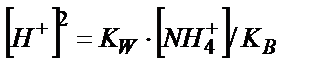
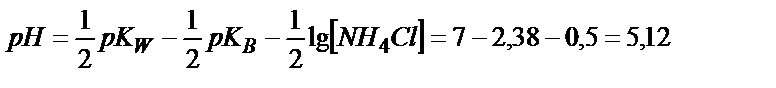
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 3603; Нарушение авторских прав?; Мы поможем в написании вашей работы!