
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тест тапсырмалары 2 страница. Эквивалентті нүктеден кейін ерітіндінің рН артық құйылған НCl мөлшерімен анықталады
|
|
|
|
Эквивалентті нүктеден кейін ерітіндінің рН артық құйылған НCl мөлшерімен анықталады.
Амииактың судағы ерітіндісін НCl ерітіндісімен титрлегенде титрлеу қисығының эквивалентті нүктесі ерітіндінің рН 7- ден төмен жағында жатыр (6.4 – сурет, 6.4 – кесте).
6.4 – кесте
10,0 мл 0,100 М аммиак ерітіндісін 0,100 М НCl ерітіндісімен титрлеу нәтижелері

| 
| pOH | 
| pH |
| 0,00 | 1,35·10-3 | 2,87 | 7,4·10-12 | 11,13 |
| 9,00 | 2,33·10-6 | 5,64 | 4,3·10-9 | 8,36 |
| 9,90 | 1,82·10-7 | 6,74 | 5,5·10-8 | 7,26 |
| 9,99 | 1,82·10-8 | 7,74 | 5,5·10-7 | 6,26 |
| 10,00 | 1,35·10-9 | 8,87 | 7,4·10-6 | 5,13 |
| 10,01 | 1,00·10-10 | 10,00 | 1·10-4 | 4,00 |
| 10,10 | 1,00·10-11 | 11,00 | 1·10-3 | 3,00 |
| 11,00 | 1,00·10-12 | 12,00 | 1·10-2 | 2,00 |
6.4 – сурет. 10,00 мл 0,100 М
| Бұл титрлеуді метилді қызыл (рТ=5,5) индикаторы қатысында жүргізуге болады. Әлсіз қышқылды әлсіз негізбен титрлегенде Ка мен Кв мәндері кішкентай болғандықтан титрлеу қисығында эквивалентті бөлігі жоқ десе де болады (6.5 – сурет). Эквивалентті нүктеге дейін ерітіндінің рН-ы сірке қышқылын NаОН ерітіндісімен титрлегендей қорытылып шы- |
ғарылады. Эквивалентті нүктеден кейін –  ерітіндісін НCl ерітіндісімен титрлегендей қорытылады. Эквивалентті нүктеде әлсіз қышқыл мен әлсіз негіздің тұзы пайда болады да, ерітіндінің рН 7 шамасында болады.
ерітіндісін НCl ерітіндісімен титрлегендей қорытылады. Эквивалентті нүктеде әлсіз қышқыл мен әлсіз негіздің тұзы пайда болады да, ерітіндінің рН 7 шамасында болады.
| VNH3·H2O, мл |
| 5 10 15 |
| рН |
6.5 – сурет 10,00 мл 0,100 М  ерітіндісін 0,100 М ерітіндісін 0,100 М  ерітіндісімен титрлеу қисығы. ерітіндісімен титрлеу қисығы.
|
6.7. Көп протонды қышқылдар мен негіздерді және
олардың тұздарын титрлеу
Көппротонды қышқылдарды күшті негізбен титрлегенде титрлеу әртүрлі жолмен жүруі мүмкін: ол протонның санына және әр сатыға сәйкес қышқылдық константалар мәніне байланысты. Екі негізді қышқылды (Н2А) титрлегенде екі эквивалентті бөлігі жақсы көрінетін қисық алу үшін: 1) Ка(1) және Ка(2) мәндері 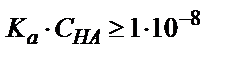 шартқа сәйкес болуы керек; 2) Екі константаның бір-бірінен мына қатынасқа Ка(1):Ка(2) ≥1:10-4 сәйкес болатындай айырмашылығы болуы керек.
шартқа сәйкес болуы керек; 2) Екі константаның бір-бірінен мына қатынасқа Ка(1):Ка(2) ≥1:10-4 сәйкес болатындай айырмашылығы болуы керек.
0,100 М Н3РО4 ерітіндісін 0,100М NаОН ерітіндісімен титрлейік. Фосфор қышқылы үш негізді қышқыл: Ка(1)=1,1·10-2; Ка(2)=2,0·10-7; Ка(3)=3,6·10-13.
Фосфор қышқылы екі сатыда титрленеді, өйткені үшінші титрлеуге сәйкес эквиваленттік бөлікті алу мүмкін емес, себебі Ка(3) мәні өте аз, сондықтан мына заңдылық 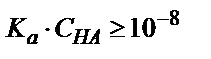 сақталмайды,
сақталмайды,  .
.
Фосфор қышқылының екінші және үшінші сатыда протонизациялану константаларының мәндері бірінші сатысына қарағанда өте аз болғандықтан бұл қышқылдың рН-ы бір негізді қышқылдың рН–ындай қорытылып шығарылады:
 ;
; 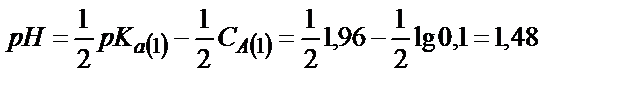
Бірінші эквивалентті нүктеге дейін ерітіндіде бос  пен
пен  қоспасы жүреді. 10,0 мл 0,100 М Н3РО4 -ке 9,00 мл 0,100 М NаОН қоссақ, 1,00мл 0,100 М Н3РО4 реакцияласпай қалады, реакцияның нәтижесінде 9,00 мл 0,100 М NаН2РО4 пайда болады.
қоспасы жүреді. 10,0 мл 0,100 М Н3РО4 -ке 9,00 мл 0,100 М NаОН қоссақ, 1,00мл 0,100 М Н3РО4 реакцияласпай қалады, реакцияның нәтижесінде 9,00 мл 0,100 М NаН2РО4 пайда болады.
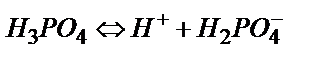
 ;
;  , осыдан
, осыдан 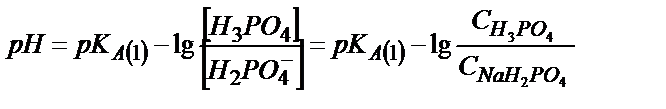
[H3PO4]= 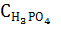 – бос қалған фосфор қышқылының концентрациясы,
– бос қалған фосфор қышқылының концентрациясы, 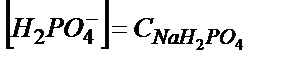 пайда болған тұздың концентрациясы.
пайда болған тұздың концентрациясы. 
Бірінші эквивалентті нүктеде 1 моль фосфор қышқылы 1 моль NaOH –пен әрекеттеседі: 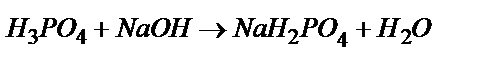
Пайда болған  ионы амфолиттік қасиет көрсетеді:
ионы амфолиттік қасиет көрсетеді:
 (6.5)
(6.5)
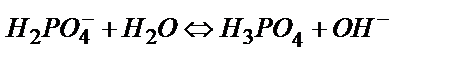 (6.6)
(6.6)
Сондықтан (6.5) теңдік бойынша пайда болған Н3О+ иондарының бір бөлігі (6.6) теңдігінен пайда болған ОН- иондарымен әрекеттесуге кетеді де:
[H3O+]+[ H3PO4]= [  ]
]
[H3O+]= [ HPO42-] – [ H3PO4] (6.7)
[HPO2-4] және [H3PO4] мәндерін табу үшін сатылай қышқылдық константаларын пайдаланады:
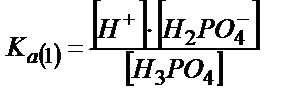 ;
; 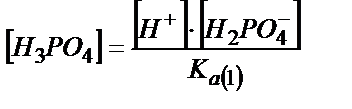 (6.8)
(6.8)

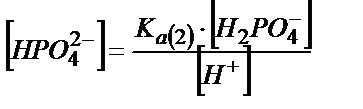 (6.9)
(6.9)
(6.8) және (6.9) теңдіктердегі мәндерді (6.7) теңдігіне қойса:
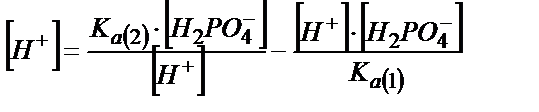 ;
; 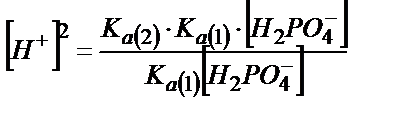
Аса сұйытылмаған ерітінділерді титрлегенде 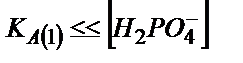 бұдан
бұдан 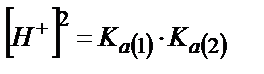 ;
; 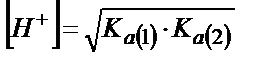
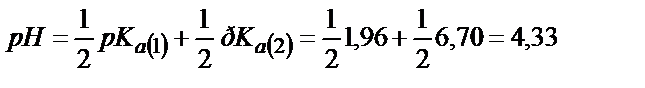 (6.10)
(6.10)
Екінші эквивалентті нүктеге дейін:
NaH2PO4 + NaOH → Na2HPO4+ Н2О
Мысалы, ерітіндіге 19,00 мл 0,100 М NaOH қоссақ нәтижесінде 1,00 мл 0,100 М NaH2PO4 бос күйінде қалады да, 9,00 мл 0,100 М Na2HPO4 пайда болады, яғни  және
және  бөлшектерінің қоспасы жүреді.
бөлшектерінің қоспасы жүреді.

 ;
; 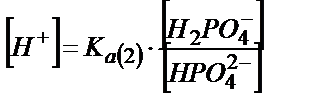 ;
;
 ;
; 
 ;
; 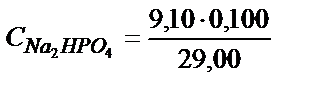
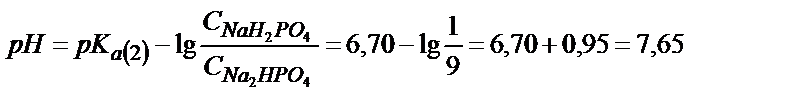
Екінші эквивалентті нүктеде 1 моль H3PO4 2 моль NaOH-пен әрекеттеседі:
H3PO4+2 NaOH → Na2HPO4+2 Н2О
Бұл нүктедегі ерітіндінің рН (6.10) байланысындай анықталады:
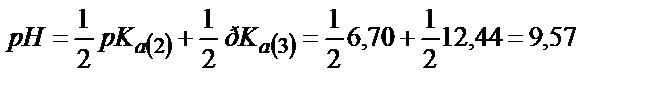
Келтірілген мәндерден мынандай қорытынды жасауға болады:
1) фосфор қышқылы екі сатыда титрленеді:
2) 1 –сатысында: H3PO4 + OH-→H2PO-4 + Н2О индикатор ретінде рТ мәні 4 – ке тең метилоранжды пайдалануға болады,  ;
;
3) 2-ші сатысында H3PO4 + 2OH-→HPO2-4 + 2Н2О – рТ 9-ға тең фенолфталеинді пайдалануға болады, 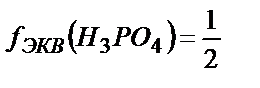 .
.
Көпнегізді әлсіз қышқылдар мен сілтілік металдардың тұздарының ерітіндісі әлсіз негіздік қасиет көрсетеді. Екі индикаторды пайдаланып көмір қышқылының натрийлі және калийлі тұздарын сатылай титрлеуге болады. Н2СО3 сатылай протонизацияланатын екі негізді қышқыл:
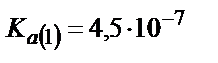 ;
; 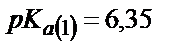


Алғашқыда 0,100 М Na2СO3 ерітіндісін алсақ:

Бірінші эквивалентті нүктеде: Na2СO3+HCl → NaHCO3+NaCl

Екінші эквивалентті нүктеде: Na2СO3+2HCl → H2CO3+2NaCl

Егер Na2СO3 ерітіндісіне фенолфталеин қосса, ерітінді ашық – қызыл түске боялады. HCl ерітіндісімен титрлеп бірінші эквивалентті нүктеге жеткенде ерітінді түссізденеді. Егер осы ерітіндіге метилоранж қосса, ол сары түске боялады. Әрі қарай тұз қышқылын құйғанда NaHCO3 түгел H2CO3- ке ауысып, ерітіндінің түсі сарыдан қызғылт түске ауысады.
Егер басынан Na2СO3 метилоранж қатысында титрленсе 1 моль Na2СO3 – ке 2 моль HCl жұмсалған болар еді:  , ал фенолфталеин қатысында титрлегенде қышқылдың мөлшері екі есе аз кетеді:
, ал фенолфталеин қатысында титрлегенде қышқылдың мөлшері екі есе аз кетеді: 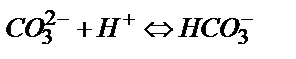 . Na2СO3 тұзының метилоранж және фенолфталеин қатысында әр түрлі сатыға дейін титрленуі NaОH пен Na2СO3, не Na2СO3 пен NaHCO3 қоспаларын титрлеуге мүмкіндік береді.
. Na2СO3 тұзының метилоранж және фенолфталеин қатысында әр түрлі сатыға дейін титрленуі NaОH пен Na2СO3, не Na2СO3 пен NaHCO3 қоспаларын титрлеуге мүмкіндік береді.
6.8. Қышқылды-негіздік титрлеудегі қателер
Титриметриялық анализдің дәлдігі ерітінділердің көлемін өлшейтін ыдыстың дәлдігімен шектеледі. Лабораториядағы өлшемдік ыдыстарды пайдаланып көлемдерді өлшегенде жіберілетін абсалютті қате ±(0,01-0,02) мл. Тек көлемді өлшеуге сәйкес салыстырмалы қате (СҚ):
СҚ 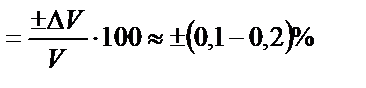
Шындығында эквивалентті нүктені анықтағанда жіберілетін қатені еске алсақ титриметриялық анализдің дәлдігі жуық мәнмен 0,5% сәйкес болады. Индикаторлы қате эквивалентті нүкте мен титрлеудің соңғы нүктесінің сәйкес келмеуіне байланысты, яғни эквивалентті нүктедегі ерітіндінің рН (рНЭ.Н.) мен пайдаланатын индикатордың тирлеу көрсеткішіне (рТ) сәйкес рН арасында айырмашылық болғаны. Сондықтан титрлеудің соңғы нүктесінде ерітіндіде не анықтайтын компоненттің, не титранттың артық мөлшері жүреді. Мысалы, жоғарыда келтірілгендей HCl ерітіндісін NaОH ерітіндісімен титрлегенде рНэ.н.=7 болғанымен, индикатор ретінде метилді қызылды (рТ=5,5) не фенолфталеинді (рТ=9,0) пайдалануға болады. рТ мен (рНЭ.Н.) арасындағы айырмашылықтан туатын қатені индикаторлы қате деп атайды. Күшті электролиттерді титрлегенде, егер рТ<рНЭ.Н. болса, титрлеудің соңғы нүктесінде ерітіндіде артық Н3О+ иондары жүреді, сондықтан бұл қатені протонды (сутектік қате) дейді. Егер рТ>рНэ.н. болса, онда соңғы нүктеде ОН- иондары артық жүреді, осыған сәйкес қате гидроксильді қате деп аталады. Әлсіз электролиттерді титрлегенде титрлеудің соңғы нүктесінде артық әлсіз қышқыл қалса, қышқыл ионизацияланбаған түрінде жүргендіктен, қатені протонды демей, қышқылдық қате дейді. Соңғы нүктеде әлсіз негіз артық қалса негіздік қате пайда болады.
Индикаторлық қателерді есептегенде олардың таңбасын көрсету қажет. Қышқылды титрлегенде протонды, не қышқылдық қате байқалса, бұл соңғы нүктеде қышқыл аяғына дейін титрленбегенін көрсетеді, сондықтан қатені теріс таңбамен белгілейді. Егер қышқылды титрлегенде гидроксильді, не негіздік қате пайда болса, яғни негіз эквивалентті мөлшерден артық құйылса, онда қатені оң таңбамен белгілейді. Негізді қышқылмен титрлегенде сәйкес қателердің таңбасы керісінше белгіленеді.
Протонды қатені былай табуға болады. Эквивалентінің молярлы концентрациясы СA болатын VA мл күшті қышқылды титрлеуге VB мл күшті негіз жұмсалды, титрлеудің соңғы нүктесін анықтауға титрлеу көрсеткіші рТ сәйкес индикатор пайдаланылды дейік. Анықтайтын қышқылдың миллимоль-эквивалент мөлшері СA·VA тең. Соңғы нүктеде (с.н.) ерітіндінің  болғанда титрлеу тоқтатылады, бұдан
болғанда титрлеу тоқтатылады, бұдан  . Соңғы нүктеде титрленбей қалған Н3О+ ионының миллимоль-эквивалент мөлшері мен титрленбей қалған мөлшері белгілі болса салыстырмалы протонды қатені
. Соңғы нүктеде титрленбей қалған Н3О+ ионының миллимоль-эквивалент мөлшері мен титрленбей қалған мөлшері белгілі болса салыстырмалы протонды қатені  пропорция құрып табуға болады:
пропорция құрып табуға болады:
СA · VA – 100 %
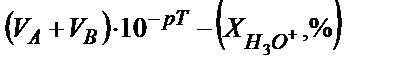 осыдан
осыдан
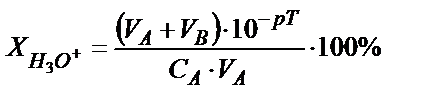
Мысалы, 25,0 мл 0,1 HCl ерітіндісін 0,1 М NaОH ерітіндісімен метилоранж индикаторы (рТ=4) қатысында титрлесе протонды қате 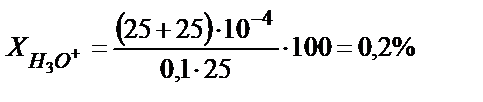 үлкен мән, сондықтан метилоранжды рТ>4 индикатормен ауыстырған жөн. Мысалы, рТ=5 метилді қызылды алса, онда
үлкен мән, сондықтан метилоранжды рТ>4 индикатормен ауыстырған жөн. Мысалы, рТ=5 метилді қызылды алса, онда

Гидроксильді қатені қышқылдық қате сияқты табуға болады, тек  ,
,  екенін еске алу керек:
екенін еске алу керек: 
Қышқылдық қате  (6.11)
(6.11)
6.5.-кесте
Титрлеу қисығын құруға сәйкес есептеу теңдіктері
| Титрлейтін зат | Титрлегенге дейін | Эквивалентті нүктеге дейін | Эквивалентті нүктеде | Эквивалентті нүктеден кейін |
| Күшті қышқыл НА | 
| 
| рН=7 | 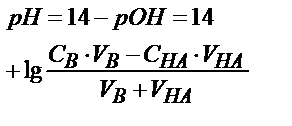
|
| Күшті негіз В (КtОН) | 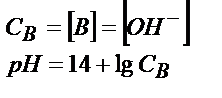
| 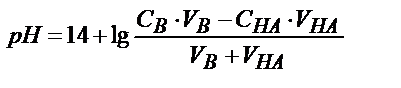
| рН=7 | 
|
| Әлсіз қышқыл НА | 
| 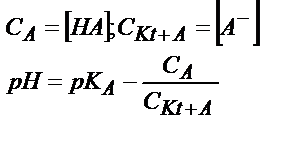
| 
| 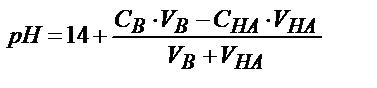
|
| Әлсіз негіз В (КtОН) | 
| 
| 
| 
|
| Көппротонды қышқыл Н2А | 
|  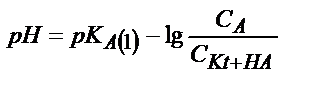
| 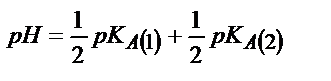
| 
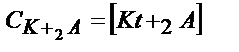
|
| 2 экв. нүкте | – | 
| 
| 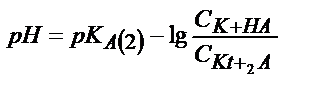
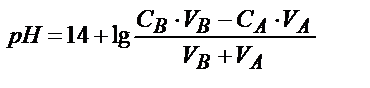
|
Бұл жағдайда 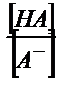 қатынасы әлсіз қышқылдың мөлшерін көрсетеді, себебі титрленген қышқыл ерітіндіде А- анионы түрінде жүреді. Егер қышқылдың протолиздену константасын еске алсақ:
қатынасы әлсіз қышқылдың мөлшерін көрсетеді, себебі титрленген қышқыл ерітіндіде А- анионы түрінде жүреді. Егер қышқылдың протолиздену константасын еске алсақ:
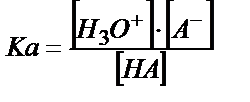 ;
; 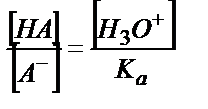 ;
; 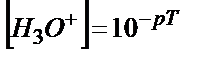 ;
;
 ;
;  (6.12)
(6.12)
(6.12) теңдігінің мәнін (6.11) теңдігіне қойсақ:
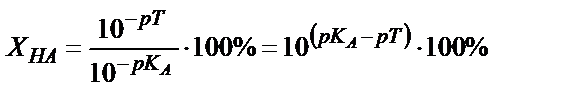 (6.13)
(6.13)
Мысалы, 0,1 М 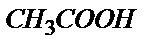 ерітіндісін 0,1М NaOH ерітіндісімен метилді қызыл (рТ=5) индикаторы қатысында титрлесе қышқылдық қате
ерітіндісін 0,1М NaOH ерітіндісімен метилді қызыл (рТ=5) индикаторы қатысында титрлесе қышқылдық қате 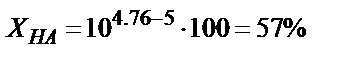 өте үлкен мән. Егер индикатор ретінде фенолфталеинді (рТ=9) пайдаланса,
өте үлкен мән. Егер индикатор ретінде фенолфталеинді (рТ=9) пайдаланса, 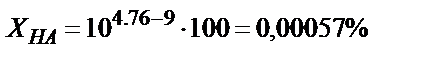 . (6,13) теңдігін пайдаланып титрлеуге қажетті инликаторды таңдап алуға болады, ол үшін қышқылдық қате өлшеу қатесінен (0,1 %) аспайтындай болу керек, яғни:
. (6,13) теңдігін пайдаланып титрлеуге қажетті инликаторды таңдап алуға болады, ол үшін қышқылдық қате өлшеу қатесінен (0,1 %) аспайтындай болу керек, яғни:

 , не
, не 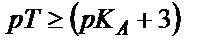 (6.14)
(6.14)
(6.14) теңдігінен әлсіз қышқылды титрлегенде индикатор ретінде титрлеу көрсеткіші (рТ) қышқылдық көрсеткіштен (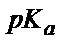 ) ең кем дегенде үш бірлікке артық индикаторды алу керек.
) ең кем дегенде үш бірлікке артық индикаторды алу керек.
Қышқылдық қате сияқты негіздік қатені былай есептеуге болады:  пайдаланатын индикатордың титрлеу көрсеткіші
пайдаланатын индикатордың титрлеу көрсеткіші 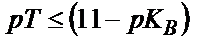 болу керек.
болу керек.
6.9. Қышқыл-негіздік титрлеуді практикада қолдану
Қышқыл – негіздік титрлеу әдістерін пайдаланып күшті қышқылдар мен негіздерді, әлсіз қышқылдар мен негіздерді және олардың тұздарын анықтайды. Қышқылдар, не негіздермен әрекеттесетін қышқылды-негіздік қасиет көрсетпейтін заттарды да анықтауға болады.
6.9.1. Карбонатты және фосфатты қоспаларды анықтау
1. NaOH және Na2СO3 қоспасын анализдеу.
NaOH пен Na2СO3 титрлеу қисығынан фенолфталеин (рТ=9) өзінің түсін NaOH түгел титрленіп, ал Na2СO3 NaНСO3-ке түгел ауысқанда өзгертеді, яғни түссізденеді (қызғылт түстен түссізге айналады):
NaOH + НCl=NaCl+H2O
Na2СO3 + НCl= NaНСO3+NaCl+ H2O (6.15)
Бұл титрлеуге V1 мл НCl кетеді. Метилоранж индикаторын қосып, қышқылмен әрмен қарай титрлесе пайда болған NaНСO3 толық реакцияласады:
NaНСO3+НCl= NaCl+ H2O+СО2 (6.16)
Егер V2 мл НCl қоспаны титрлеуге кеткен қышқылдың жалпы көлемі болса, онда (V2 – V1) айырмашылығы қышқылдың (6.16) – реакцияға кеткен көлемін көрсетеді. (6.15) және (6.16) – реакцияларға тұз қышқылының бірдей көлемі жұмсалғандықтан 2(V2-V1) мл НCl Na2СO3-ті түгел титрлеуге кететін көлем болады. Ал NaOH –ты титрлеуге кететін көлем жалпы көлем мен Na2СO3-ті титрлеуге кеткен көлемнің айырмашылығына тең:
V2-2(V2-V1)=(2·V1-V2) мл НCl.
Осы мәліметтерді пайдаланып Na2СO3 пен NaOH массаларын табуға болады:


1. Екі индикаторды пайдаланып (NaНСO3+ Na2СO3) қоспасын да титрлеуге болады. Фенолфталеиннің түссізденгені (6.15) – реакциясының аяғына дейін жүргенін көрсетеді (V1 мл НCl), ал метилоранж түсінің өзгеруі (6.16) – реакциясының аяқталғанына сәйкес болады. Егер қоспаны титрлеуге кеткен қышқылдың жалпы көлемі V2 мл болса, онда (V2-2V1) мл НCl алғашқы қоспада жүрген NaНСO3 –ті титрлеуге жұмсалады. Осыдан:


2. Күкірт және фосфор қышқылдарының қоспасын анықтауға да екі индикатор пайдалануға болады. Екі қышқылдың қоспасын метилоранж қатысында NaOH ерітіндісімен титрлесе мынандай реакциялар жүреді:
H2SO4+2NaOH=Na2SO4+2 H2O
H3PO4+ NaOH= NaH2PO4 + H2O
ал фенолфталеин қатысында жүретін реакция:
NaH2PO4+ NaOH= Na2HPO4+H2O
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1303; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 ерітіндісін 0,100 М НCl ерітіндісімен титрлеу қисығы.
ерітіндісін 0,100 М НCl ерітіндісімен титрлеу қисығы.