
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тест тапсырмалары 1 страница
|
|
|
|
ТАРАУ
Қышқыл-негіздік реакциялар
5.1. Қышқылдар мен негіздердің протолиттік теориясы. Автопротолиз
Қышқылдар мен негіздердің классикалық ұғымы швед химигі Ааррениус ұсынған электролиттік диссоциация теориясына негізделген. Бұл теория бойынша қышқылдар құрамында сутегі бар заттар, диссоциацияланғанда сутегі ионы мен аниондарға ыдырайды.
HA↔ Н+ + А-
Ал негіздер құрамында гидроксил топшасы бар заттар, суда ерігенде гидроксил ионы мен катиондарға ыдырайды.
BOH↔В+ +ОН-
Аррениус теориясының негізгі кемшілігі – диссоциациялану процесіне еріткішің әсерінің ескерілмеуі. Бұл теория сусыз ертінділерге қолданылмайды.
1923 жылы Бренстед және Лоури қышқылдар мен негіздердің протолиттік теориясын ұсынды. Бұл теория бойынша протонды бөліп шығаратын заттар қышқылдар қатарына жатады, протонды қосып алатын заттар – негіздер. Сонымен негіз мынадай реакцияға қатысады:
Қышқыл ↔ негіз +протон
А ↔ В + Н+
Әр қышқылға сәйкес негіз пайда болады. Бір протолиттік жүйеге сәйкес қышқыл мен негізді қосарласқан жұп дейді. Мысалы:
А↔ В + Н +
НСІ↔ СІ – +Н+
Н2 SО4↔ НSО4-+Н+ (5.1)
НSО4-↔ ↔ SО42- +Н+
Н3 РО4 ↔ Н2 РО4-+Н+
Н2РО4-↔ НРО42-+Н+
NН4+ ↔ NН3 +Н+
АІ(Н2О)63+ ↔ АІ(ОН)(Н2О)52+ + Н+
Қышқыл деген ұғым НСІ, Н2SО4 сияқты бейтарап молекулалардан басқа зарядталған НSО4-, NН4+ бөлшектерге де қатысты. Сондықтан қышқылдар бейтарап, анионды және катионды болып бөлінеді. Өзін қышқыл және негіз түрінде көрсететін бөлшектер де болады, олар – амфолиттер.
Реалды жағдайда қышқылды-негіздік реакция екі қосарласқан жұптың арасында жүреді. Жұптың біреуі протонды береді (донор), ал екіншісі оны қосып алады (акцептор). Хлорлы сутегінің судағы ертіндісінде:
НСІ↔ СІ- +Н+
Н+ +Н2О ↔ Н3О
НСІ +Н2О ↔ Н3О++СІ- (5.2)
Бұл жағдайда НСІ протонның доноры (қышқыл), ал Н2О протонның акцепторы (негіз).
Аммиактың судағы ертіндісінде жүретін реакция:
Н2О ↔ ОН- +Н+
Н++ NН3 ↔ NН4+
Н2О+ NН3 ↔ NН4++ОН- (5.3)
Бұл жағдайда протонның доноры су (қышқыл), ал оның акцепторы NН3 (негіз).
Сол сияқты (5.1) теңдіктері:
Н2 SО4 + Н2О ↔ НSО4- + Н3О+
Н SО4- +Н2О ↔ SО42- +Н3О+ (5.4)
Н3РО4+Н2О↔ Н2РО4- +Н3О+
Н2РО4- + Н2О↔ НРО42-+ Н3О+
NН4+ + Н2О↔ NН3 +Н3О+
АІ(Н2О)63++ Н2О↔[АІ(ОН)(Н2О)5]2++ Н3О+
(5.2), (5.4) реакцияларда судың молекуласы протонның акцепторы ролін атқарып тұр, сондықтан ол негіздік қасиет көрсетеді. (5.3) және мына реакцияларда:
Н2О + СО32- ↔НСО3- +ОН-
Н2О + Н2РО4-↔Н3РО4+ОН-
Н2О + +СН3СОО- ↔ СН3СООН + ОН- (5.5)
судың молекуласы протонның доноры болғандықтан қышқылдық қасиет көрсетіп тұр.
Келтірілген мысалдарда Н2РО4- қышқылдық және негіздік қасиет көсетеді:
Н2РО4- + Н2О↔ НРО42-+ Н3О+
Н2О + Н2РО4-↔ Н3РО4+ОН-
Мұндай заттар амфолиттер деп аталады.
Протолиттік теорияның маңызды жетістігіне еріткіштің қышқылды-негіздік тепе-теңдіккке тигізетін әсерін ескеруі жатады. Жалпы түрде қышқыл мен негіздің диссоциациялануын былай жазуға болады:
НА +НSоlv↔ Н2Sоlv++А-, немесе А- + НSоlv ↔ НА +Sоlv-
Протонның бір заттан екінші затқа ауысуы газ түріндегі және қатты фазаларда да жүреді.
Қышқылдық та, негіздік те қасиет көрсететін еріткіштерді амфипротты, не амфипротонды еріткіштер дейді. Мысалы, таза суда мынадай протолиттік реакция жүреді:
Н2О + Н2О ↔ Н3О+ + ОН- (5.6)
Протонның бірдей бөлшектердің арасында бірінен біріне ауысуын автопротолиздену, не қышқылды – негіздік диспропорциялану процесі деп атайды. Таза суда Н3О+ және ОН- иондарының концентрациялары бірдей. Судың концентрациясы тұрақты болғандықтан (55.3 моль/л) (5.6) реакциясының тепе – теңдік константасы:
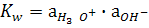 (5.7)
(5.7)
Бұл константаны автопротолиздану, не судың иондық көбейтіндісі (КW) дейді. Автопротолиздену тепе-теңдігі солға қарай ығысқандықтан Н3О+, ОН- иондарының активтіктері аз. Сондықтан тәжрибеде бұл мәндердің теріс логарифмін пайдаланған ыңғайлы:
-lg КW= p КW; -lg  = pH; -lgaОН-= pОН
= pH; -lgaОН-= pОН
(5.7) теңдігі былай жазылады:
pКW = pH + pОН (5.8)
(5.6) автопротолиздану реакциясы жүргенде бірдей мөлшерде Н3О+ және ОН- иондары пайда болады. Сондықтан ортаның бейтараптығы осы екі иондардың активтіктерінің теңдігімен анықталады:
 pH = pOH =
pH = pOH =  pКW
pКW
Егер гидроксоний ионының активтігі гидроксил ионның активтігінен көп болса орта қышқылдық болады:
 pH < pОH
pH < pОH
Керісінше гидроксил ионның активтігі гидроксоний ионның активтігінен көп болса орта негіздік (сілтілік) болады:
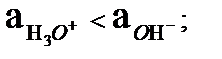 pH > pОH
pH > pОH
КW мәні температураға байланысты:
| Температура, 0С | |||||
| p КW | 14,92 | 14,0 | 13,26 | 12,60 | 12,26 |
25 0С-та КW =1,10-14
Таза суда және сұйытылған сулы ертінділерде активтікті концентрациямен ауыстыруға болады:
КW =[ Н3О+].[ОН -] (моль2/л2)
Қарапайым түрінде: КW =[ Н+].[ОН -]
[ Н+] = [ОН-] = 10 -7 ; -lg КW= -lg [ Н+] +(-lg [ОН-])
pКW = pH+рОН = 14 – автопротолиз константасының көрсеткіші.
Амфипротты еріткіштерге (Hsolv) сәйкес автопротолиздану реакциясының жалпы түрі:
НSolv+ Hsolv ↔ H2solv+ + Solv-
Автопротолиз реакциясында ерткіштің бір молекуласы қышқыл, екінші молекуласы негіз рөлін атқарады. Сондықтан Hsolv- Solv- және Hsolv- H2solv+ әрқайсы қосарласқан қышқылды негіздік жұп құрайды. H2solv+иондарын лионий иондары, ал Solv- лиат иондары дейді. Автопротолиз константасы лионий және лиат иондарының активтіктерінің көбейтіндісіне тең:
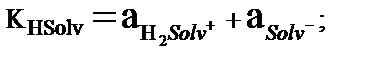
Автопротолиз константасы еріткіштің өте маңызды термодинамикалық сипаттамасы. Автопротолиз көрсеткіші pКHsolv = – lg KHsolv тікелей еріткіштің қышқылдық шкаласының кеңдігін көрсетеді. Егер қышқылдық аралығын
 =I-ден
=I-ден  =I дейін алсақ, рН мәндерінің аралығы 0-ден pK Hsolv дейін болады, яғни бұл аралық суға 14,00 тең, метанолға 17,31 –ге тең, сірке қышқылына 12,22-ге тең, т.б.
=I дейін алсақ, рН мәндерінің аралығы 0-ден pK Hsolv дейін болады, яғни бұл аралық суға 14,00 тең, метанолға 17,31 –ге тең, сірке қышқылына 12,22-ге тең, т.б.
5.2. Қышқылдар мен негіздердің судағы ерітінділеріндегі тепе-теңдік
Қышқылдар мен негіздердің суда протолиздену дәрежесінде бір-бірінен айырмашылық болуы мүмкін. Күшті протолиттер еріткішпен түгел әрекеттеседі, әлсіз протолит жарым-жартылай әрекеттеседі де, алғашқы заттың едәуір бөлігі тепе-теңдік қоспасында өзгермеген түрде қалады. Мысалы, тұз қышқылының ертіндісінде:
НСІ –дың бар молекулалары Н3О+ және СІ- иондарына диссоциацияланған.
І М сірке қышқылының ертіндісінде тек 1% – тей қышқыл ацетат-ионы мен гидроксоний – ионына ыдырайды. Қышқыл күшінің сандық өлшемі әрекеттесуші массалар заңын пайдаланып алынған тепе-теңдік константасы болады.
НА + Н2О ↔ Н3О++А- СН3СООН +Н2О ↔ СН3СОО- + Н3О+
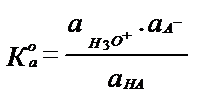

Ка – қышқылдық константа.
Осы сияқты негіздің протолизденуінен
Н2О +В ↔ А + ОН- Н2О + NН3 ↔ NН4+ + ОН-

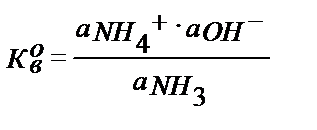
К в – негіздік константа.
Жиі Ка мен К в орнына олардың теріс логарифміне сәйкес рКа, рК в – қышқылдық және негіздік константаларының көрсеткіштері алынады
Қосарласқан қышқылды – негіздік жүптың константалары өзара байланысқан:
НА +Н2О ↔ Н3О+ +А- 
А- +Н2О ↔ НА +ОН- 
 (5.9)
(5.9)
Белгілі ертіндіде қышқылдық константа мен қосарласқан негіздің негіздік константасының көбейтіндісі осы еріткіштің автопротолиздану константасына тең:
Ка·К в = КW; рКа + рК в = рКW = 14 (5.10)
(5.9), (5.10) теңдіктерін пайдаланып қышқылдық не негіздік константасы мәнінен алғашқы затпен қосарласқан қышқылдың не негіздің протолиздену константасын табуға болады. Мысалы:
Н3СООН +Н2О ↔ СН3СОО- +Н3О+
 ; рКа =рК СН3СООН=4,76
; рКа =рК СН3СООН=4,76
СН3СОО- + Н2О↔ СН3СООН + ОH- (5.11)
рКW = рК СН3СООН + pK СН3СОО- = 14
рК в = pK СН3СОО- = рКW – рК СН3СООН= 14 – 4,76=9,24,
не Н2О + NН3 ↔ NН4+ + ОН- (5.12)
 ; рК в = р
; рК в = р  =4,60
=4,60
NН4+ + Н2О ↔ NН3+ Н3О+ (5.13)
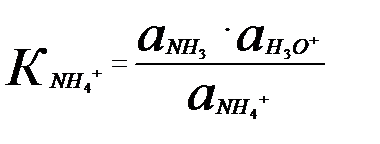
р  +р
+р  = рКW; рКа = р
= рКW; рКа = р  = рКW – р
= рКW – р  =14-4,6=9,4.
=14-4,6=9,4.
Еске алатын бір жай, судағы ерітіндіде қышқылдық және негіздік константалардың сандық мәні классикалық теория бойынша қышқыл мен негіздің диссоцияциялану константаларына сәйкес. Мысалы, сірке қышқылына:
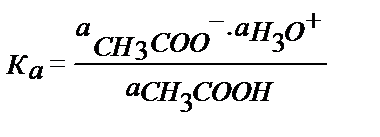 ;
; 
Бұл байланыс классикалық теорияға негізделіп жасалынған анықтама кестелерін пайдалануға мүмкіншілік береді.
(5.11), (5.12) реакциялары классикалық теория бойынша гидролиздену, яғни еріген заттың сумен алмасып ыдырау реакциясына жатады. Протолиттік теориясы шеңберінде бұл жағдайда иондық түріндегі негіз (СН3СОО-) бен қышқылдың (NН4+) протолизі жүреді.
Гидролиздену константасы – қышқылмен қосарласқан негіздің, не негізбен қосарласқан қышқылдың константалары. Сондықтан бұл реакцияларға гидролиздену деген терминді пайдаланбаса да болады.
(5.9) теңдігі бойынша қышқылдың күші қосарласқан негіздің күшіне кері пропорционалды. Мысалы, өте күшті хлор қышқылына НСlО4 өте әлсіз негіз СlО4- сәйкес. Күші орта протолиттердің тікелей және кері жүретін протолиттік реакцияларының жылдамдығы бір-біріне шамалас, яғни қосарласқан қышқыл мен негіздің константаларының айырмашылығы аз. Мысал:
H2S + H2O ↔ HS-+ H3O+; рКа =6,92; рКв = 7,08.
Амфипротты судың молекуласы бір мезгілде әлсіз қышқыл және әлсіз негіз қасиетін көрсетеді. Су протолизденгенде қатарласқан күшті қышқыл – сольватталған протон H3O+ және қатарласқан күшті негіз-гидроксид ОH- пайда болады.
Н2О +Н2О ↔ Н3О+ + ОН-
Күшті қышқыл суда ерігенде ол еріткіштің молекуласымен реакцияласу нәтижесінде толық гидроксоний ионына айналады:
НСІО4 + Н2О → Н3О+ +СІО-4
Сондықтан хлор қышқылының күші амфипротты еріткіш судағы гидроксоний ионының қышқылдық күшімен шектеледі. Н3О+ – сулы ертіндідегі ең күшті қышқыл. Сол сияқты күшті негіз суда ерігенде негіздің күші гидроксил ионының күшіне сәйкес болады. Судағы ерітіндідегі ең күшті негіз ОН--иондары.
Осыған сәйкес НСІ, НСІО4, Н2SО4 т.б. сияқты толық ионизацияланатын күшті қышқылдардың судағы қышқылдығы бір-біріне тең, себебі олардың күші Н3О+ – иондарының қышқылдық қасиетімен анықталады. Мұндай әсерді еріткіштің нивелирлеу (тегістеу) әсері дейді. Гидроксил – ионынан гөрі күшті негіздер судағы ертіндіде ОН- деңгейіне дейін нивелирленеді.
5.2.1. Күшті қышқылдар мен негіздердің ертінділері
Протолиттердің рН-ы үлкен дәлдікпен анықталғанда протолиттің еріткіш молекулаларымен әрекеттесуінен пайда болған гидроксоний иондарымен қатар еріткіштің автопротолизі нәтижесінде пайда болған гидроксоний иондарын да еске алу керек.
НА + Н2О ↔ Н3О+ + А- (5.14)
Н2О + Н2О ↔ Н3О+ + ОН- (5.15)
Егер НА, А- бөлшектерінің аналитикалық концентрацияларын СНА , СА-, ал тепе – теңдік концентрацияларын [НА], [А-] деп белгілесек
[НА] = СНА – ([Н3О+]Ж – [ОН-]) (5.16)
[А-] = СА- + ([Н3О+]Ж – [ОН-]) (5.17)
(5.14) теңдігінен пайда болған гидроксоний иондарының концентрациясы осы иондардың жалпы концентрациясы
([Н3О+]Ж =[Н3О+]НА +  )
)
мен гидроксид -иондарының концентрацияларының айырымына тең ([Н3О+]ж – [ОН-]). НА бөлшегінің аналитикалық концентрациясы (5.14) теңдігі бойынша пайда болған Н3О+ иондарының мөлшеріне кемиді. А- бөлшегінің аналитикалық концентрациясы керісінше осы мәнге артады (5.16 – 5.17 теңдіктері). НА күшті қышқыл, сондықтан оның протолиздену реакциясы аяғына дейін жүреді де [НА] = 0.
5.16. теңдігінен:
[Н3О+] = СНА + [ОН-] = СНА + КW / [Н3О+] (5.18)
Егер СНА >> 10-6 моль/л болса (5.18) теңдігіндегі екінші мүшені еске алмаса да болады, онда [Н3О+] = СНА, сол сияқты [ОН-] = СА-. Мысалы, 0,01М НСІ ертіндісінде [Н3О+]= СНСІ=10-2, рН=2. 0,01М NаОН ертіндісінде [ОН-] = СNаОН =10-2; рОН = 2, рН = 14 – 2 =12.
Егер күшті электролиттің концентрациясы 10-6 М төмен болса (СНА<10-6 моль/л), еріткіштің автопротолизі нәтижесінде пайда болған гидроксоний иондарын еске алу қажет. (2.18) теңдігінен:
[Н3О+]2 – СНА . [Н3О+] – КW = 0
[Н3О+] – мәнін табу үшін квадрат теңдікті шешу керек.
5.2.2. Әлсіз қышқылдар мен негіздердің ерітінділері
Әлсіз қышқылдың ертіндісінде протолиттік реакция оңнан солға қарай ығысқан, сондықтан ертіндіде қышқыл НА түрінде жүреді, тек оның азғантай мөлшері гидроксоний ионына айналады. Жуық есептеулерде [НА] ≈ СНА деп алуға болады. Сонымен қатар:
НА + Н2О ↔ Н3О+ + А- теңдігінен [Н3О+] = [А-].
Келтірілген мәндерді қышқылдық константаның теңдігіне қойсақ:

Егер К0а= КСа деп алсақ:
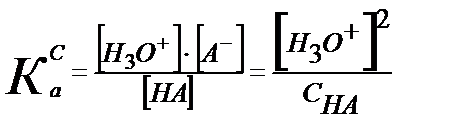
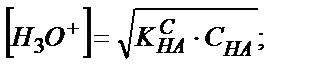 -lg [Н3О+] = –
-lg [Н3О+] = –  lg K CHA –
lg K CHA –  lg CHA;
lg CHA;
pH =  pKCHA –
pKCHA –  lg CHA (5.19)
lg CHA (5.19)
Мысалы: 0,01М а) сірке қышқылының, б) аммоний хлоридінің судағы ертінділерінің рН-ы: 
а) рН = 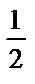 pK
pK 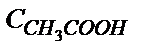 –
–  lg
lg 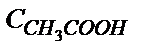 =
=  4,76 –
4,76 –  lg 10-2 = 3,40;
lg 10-2 = 3,40;
б) NН4++Н2О↔Н3О++NН3; 
Әлсіз негіздердің судағы ертіндісінде протолитті реакция оңнан солға қарай ығысқан: В+ Н2О↔ВН++ОН-. Жуық есептеулерде [В] ≈ СВ; [ВН+] = [ОН-]


рОН = 1/2рКСВ – 1/2 lg CВ
рН = pKW – pOH =pKW -(1/2) pKCB +(1/2) lg CB (5.20)
Мысалы: 0,01M а) амиактың, б) сірке қышқылды натрийдің судағы ертінділерінің рН-ы:
а) рН = 14 –  ·4,6 +
·4,6 +  lg 10-2 = 14 – 2,3 – 1 = 10,70;
lg 10-2 = 14 – 2,3 – 1 = 10,70;
б) СН3СОО- +Н2О ↔ СН3 СООН + ОН-
рН=14– 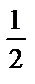 pKCСН3СОО-+
pKCСН3СОО-+  lgССН3СОО- =14 –
lgССН3СОО- =14 –  ·9,2+
·9,2+  lg10-2=14–4,6–1=8,40.
lg10-2=14–4,6–1=8,40.
Егер протолиттердің ертіндісі өте сұйытылған болса, не қышқылдық (негіздік) константалардың мәні үлкен болса рН – мәнін есептеу күрделенеді:
НА + Н2О ↔ Н3О+ + А- ; [Н3О+] = [А-] = X; [НА] = СНА – Х

Х 2 + Ка ·Х + Ка ·СНА = 0

не 
5.2.3. Әлсіз қышқыл мен қосарласқан негіздің немесе әлсіз негізбен қосарласқан қышқылдың ерітінділері. Буферлі ерітінділер
Қосарласқан қышқылды-негіздік жұбы бар ертінді екі бәсекелес тепе-теңдікке байланысты қышқылдық, сілтілік, не бейтарап болуы мүмкін.
НА-әлсіз қышқылы мен оның натрий тұзының NaА қоспасы бар ертіндіде:
НА + Н2О ↔ Н3О+ + А-,  (5.21)
(5.21)
А- + Н2О ↔ ОН- + НА,  (5.22)
(5.22)
Егер (5.21) тепе-теңдік (5.22) тепе-теңдікке қарағанда оң жаққа көбірек ығысқан болса ертіндінің қышқылдығы (5.21) тепе – теңдіктен анықталады:
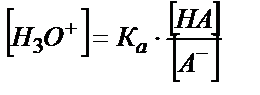 ; [НА] = СНА; [А-] = СА-
; [НА] = СНА; [А-] = СА-
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2048; Нарушение авторских прав?; Мы поможем в написании вашей работы!