
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стандартты ерітінділер дайындау
|
|
|
|
ТАРАУ
Титриметриялық анализ
4.1. Титриметриялық анализдің мәні
Титриметриялық әдіс анықтайтын затпен реакцияласуға жұмсалатын реактивтің мөлшерін дәл өлшеуге негізделген.
Жиі реактивтің мөлшерін табу үшін концентрациясы белгілі ерітіндінің әрекеттесуге кеткен көлемін анықтайды, сондықтан бұл әдіс көлемдік анализ деп те аталады.
Аналитикалық химияда титр (Т) ерітіндінің концентрациясын белгілеудің бір жолы. Титр – 1 мл ерітіндідегі еріген заттың грамм не миллиграмм мөлшері. Титрі анық белгілі ерітіндіні титрленген, не стандартты ерітінді дейді. Титрлеу деп стандартты ерітіндіні анализдейтін ерітіндіге ептеп эквивалентті нүктеге жеткенше қосу процесін айтады. Эквивалентті нүкте қосылған титранттың анықтайтын затқа химиялық эквивалентті мәні. Химиялық элементтер, не олардың қосылыстары бір-бірімен олардың химиялық эквиваленттеріне сәйкес белгілі массалық мөлшерде әрекеттеседі. Басқа сөзбен айтқанда бір заттың мольэквиваленті (мэкв) екінші заттың сонша мольэквивалентімен реакцияласады. Титрлейтін ерітіндіні жиі жұмыс ерітіндісі, не титрант деп атайды.
Титриметриялық әдісте кез-келген химиялық реакциялар пайдалана берілмейді. Титриметрияда пайдаланылатын реакциялар белгілі шарттарға жауап берулері керек:
1) Реакция аяғына шейін жүруі керек. Анализдің нәтижесі дұрыс болу үшін титранттың эквивалентті мөлшері қосылғанда реакцияның толық жүру мәні 99,9%-тен кем болмау керек.
2) Реакция үлкен жылдамдықпен жүруі керек.
3) Ерітіндіде титрант тек анықтайтын затпен белгілі стехиометриялық қатынаста реакцияласуы қажет.
4) Реакцияның аяқталғанын, яғни эквивалентті нүктені анықтайтын мүмкіншілік болу керек. Егер бұл нүкте тәжрибеде индикатордың түсінің өзгеруіне, не ерітіндінің электрохимиялық не физикалық қасиетінің өзгеруіне сүйеніп табылса, оны титрлеудің соңғы нүктесі (т.с.н.) деп атайды. Титранттың теориялық жолмен есептелген мөлшері құйылған нүктені титрлеудің эквивалентті нүктесі (т.э.н.) дейді. Идеалды жағдайда титрлеудің соңғы нүктесі мен эквивалентті нүкте бір-біріне сәйкес келеді, бірақ әртүрлі себептерге байланысты (мысалы, индикатордың бояуының титранттың сәл артық мөлшерін құйғанда ғана өзгеруі т.б.) бұл нүктелердің арасында азырақ айырмашылық болуы мүмкін.
4.2. Титриметриялық анализ әдістерінің классификациясы (жіктелуі)
Титриметриялық анализ әдістерін анализде пайдаланылатын химиялық реакциялардың түріне қарай бөледі. Бұл реакциялар: протондар алмасатын, электрондар алмасатын, аз диссоциацияланатын (комплекстік) бөлшектер түзетін және нашар еритін қосылыстар түзетін реакциялар. Осыған байланысты титриметриялық анықтауды мынадай әдістерге бөлуге болады:
1. қышқыл-негіздік титрлеу (протолитометрия);
2. тотығу-тотықсыздану титрлеуі (редоксиметрия);
3. комплексометриялық титрлеу (комплексометрия);
4. тұнба алып титрлеу (седиметрия).
Титриметриялық әдістерді титрлеу жолына қарап та бөледі;
1. тікелей титрлеу әдісі – анықтайтын зат концентрациясы белгілі ерітіндімен титрленеді;
2. ауыстыру (жанама) әдісі – бұл әдіс анықтайтын зат пайдаланатын реагентпен әрекеттеспейтін, не реакция стехиометриялық жолмен жүрмейтін жағдайда пайдаланылады. Мысалы, кальций иондарын перманганатометрия әдісімен анықтау. Кальций иондарын қымыздық қышқылы аниондарымен тұнбаға түсіреді:
Ca2++C2O42-→CaC2O4↓
Жуылған тұнбаны күкірт қышқылында ерітеді:
CaC2O4↓+2H3O+→H2C2O4+Ca2++2H2O
Пайда болған қымыздық қышқылын калий перманганаты ерітіндісімен титрлейді:
5H2C2O4+2MnO4-+6H3O+ 10CO2+2Mn2++14H2O
3. кері титрлеу әдісі – анализдейтін ерітіндіге артық мөлшерде алынған титранттың белгілі көлемін құяды, яғни анықтайтын компонентпен реакция толық жүргеннен кейін ерітіндіде титранттың бос мөлшері қалады. Реакцияласпай қалған титранттың мөлшерін концентрациясы белгілі басқа ерітіндімен титрлейді. Алғашқы қосылған титранттың көлемі мен оның реакцияласпай артық қалған көлемінің арасындағы айырмашылық титранттың анықтайтын затпен әрекеттесуге кеткен көлемін көрсетеді.
4.3. Титриметриялық анализ нәтижелерін есептеу
1. Ерітінділердің концентрациясын белгілеу.
Молярлы концентрация, СМ әрпімен белгіленеді, 1 дм3 (л) ерітіндідегі еріген заттың моль санын nA, не 1 см3 (мл) ерітіндідегі еріген заттың миллимоль санын көрсетеді. Заттың бір молі оның граммен не миллиграммен алынған молярлы массасы М(X): n(моль)=m(г)/М(X)г/моль; n(ммоль) = m(мг) / М(X) г/ммоль. Ерітіндідегі еріген заттың массасын (m) табу үшін оның моль санын бір мольдің массасына (молярлық масса) көбейту керек. Мысалы, концентрациясы 0,2 M күкірт қышқылының ерітіндісінде CH2SO4=0,2 M=0,2 моль/л; M(H2SO4)=98,08 г/моль;
m(H2SO4)=0,2 моль/л. 98,08 г/моль=19,6 г/л, яғни 19,6 г H2SO4 бір литр ерітіндіде еріп жүр. Жалпы түрде m(X)=С. M(X).
Эквиваленттің молярлы концентрациясы С(f э, Х) әрпімен белгіленеді, 1 дм3 (л) ерітіндідегі еріген заттың мольэквивалент санын nЭ, не 1 см3 (мл) ерітіндідегі еріген заттың миллимольэквивалент санын көрсетеді. Мысалы,
H2SO4+2NaOH=Na2SO4+2H2O,
не 1/2H2SO4+NaOH=1/2Na2SO4+H2O
мольэквивалент H2SO4=1/2 моль H2SO4
1/2 – эквиваленттік фактор деп аталады – fэкв. Қышқылды-негіздік реакцияларда fэкв әрекеттесуге қатысқан сутек иондарының санымен, ал тотығу-тотықсыздану реакцияларында тотығу, не тотықсыздану реакциясына қатысқан электрондар санымен анықталады.
fэкв мәні жүретін реакцияның теңдігіне байланысты 1сутегі ионына не 1 электронға сәйкес (эквивалентті) заттың (ион, молекула т.б.) үлесін көрсетеді:
H3PO4+NaOH=NaH2PO4+H2O fэкв(H3PO4)=1
H3PO4+2NaOH=Na2HPO4+2H2O fэкв(H3PO4)=½
H3PO4+3NaOH=Na3PO4+3H2O fэкв(H3PO4)=1/3
не KMnO4+5FeCl2+8HCl=MnCl2+5FeCl3+4H2O+KCl
MnO4-+8H++5e→Mn2++4H2O fэкв(KMnO4)=1/5
Fe2+–1e→Fe3+fэкв(Fe)=1
С(f э, Х) концентрациясы арқылы берілген ерітіндідегі еріген заттың массасын табу үшін оның мольэквивалент санын бір мольэквиваленттің массасына n(Мэ) көбейту керек. Бір мольэквиваленттің массасы молярлық масса мен эквиваленттік фактордың көбейтіндісіне тең:
Мысалы, мольэквивалент H2SO4–M(1/2 H2SO4)=fэкв(H2SO4). M(H2SO4)=1/2. 98,08=49,04 г/моль.
Мольэквивалент KMnO4–M(1/5 KMnO4)=fэкв(KMnO4). M(KMnO4)=1/5.158,0=31,6 г/моль.
С(1/2H2SO4)=0,1М=0,1. fэкв моль/л, m(H2SO4) = 0,1fэкв(H2SO4) M(H2SO4) = 0,1 моль/л 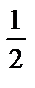 . 98,08 г/моль = 4,904 г/л
. 98,08 г/моль = 4,904 г/л
C(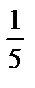 KMnO4)=0,5М,
KMnO4)=0,5М,
m(KMnO4)=0,5.M(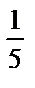 KMnO4)=0,5. fэкв(KMnO4);
KMnO4)=0,5. fэкв(KMnO4);
m(KMnO4)=0,5 моль/л. 31,16 г/моль=15,8 г/л.
Жалпы түрде m(X)=Сн. fэкв. M(X).
Ерітіндінің титрі, Т әрпімен белгіленеді, ол – 1 мл ерітіндідегі еріген заттың грамм, не миллиграмм мөлшері.
Егер ерітіндінің молярлы, не нормальды концентрациялары белгілі болса бұл ерітіндінің титрін былай табуға болады:
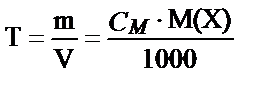 ; не
; не 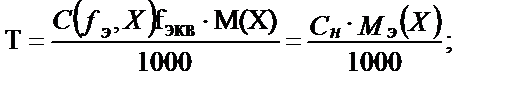
Керісінше ерітіндінің титрі белгілі болса, оның молярлы не нормальды концентрациясы жеңіл табылады:
 ;
; 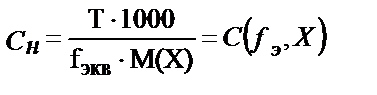 ;
;
Мысалы, 250 мл ерітіндіде 24,52 г H2SO4 еріп жүр. Осы ерітіндінің Т, СМ және Сн (fэкв = 1/2) неге тең деген сұраққа былай жауап беруге болады:
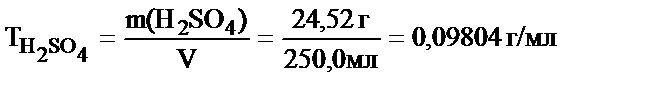
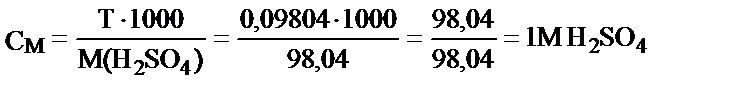
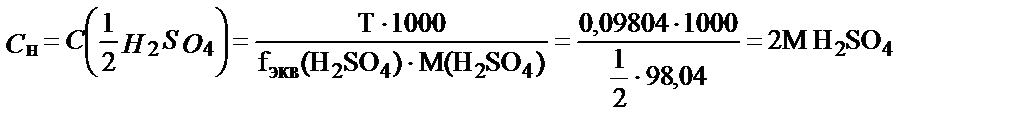
Жұмысшы ерітіндінің анықтайтын зат арқылы титрі – TЖ/А, бұл анықтайтын заттың 1 мл жұмысшы ерітіндімен әрекеттесетін грамм мөлшері.
Мысалы, TH2SO4/CaO=0,004679 г/мл, 1 мл күкірт қышқылы 0,004678 г CaO-мен әрекеттеседі. Ерітіндінің эквивалентінің молярлы концентрациясы белгілі болса, оның анықтайтын зат арқылы титрін табу қиын емес:
 ;
;
 .
.
Ерітіндінің концентрациясын анықтайтын зат арқылы титрмен белгілеудің тиімділігі – анализдің нәтижесін есептеу жеңілденеді: mА=VЖ. ТЖ/А. Мысалы, темір анықталатын ерітіндіні титрлеуге 20,00 мл ТKMnO4/Fe=0,005850 г/мл KMnO4 ерітіндісі жұмсалады. Егер 1 мл KMnO4 ерітіндісі 0,005850 г темірмен әрекеттесетін болса, онда 20,00 мл KMnO4 20,00 мл. 0,005850 г/мл грамм темірмен әрекеттеседі:
mFe = TKMnO4/ Fe. VKMnO4= 0,005850 г/мл. 20,00 мл = 0,1170 г.
Ерітіндінің проценттік концентрациясы (С %) 100 г ерітіндідегі еріген заттың грамм мөлшерімен белгіленеді. Мысалы, 3 % NaCl ерітіндісі десе, ол 100 г ерітіндіде 3 г NaCl және 97 г су барын көрсетеді.
Процентті концентрациядан молярлы не эквиваленттің молярлы концентрациясына ауысу үшін ерітіндінің тығыздығын еске алу керек. Ерітіндінің массасы (Р), оның тығыздығы (r) және көлемінің (V) арасындағы байланыс P = V. r, не V = 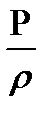 .
.
Мысалы, тығыздығы 1,14 г/мл 20,0 % күкірт қышқылының молярлы және эквивалентінің молярлы концентрацияларын табайық: fэкв (H2SO4) = 1/2. Алдымен 100 г 20,0 % ерітіндінің алатын көлемін табамыз: V= 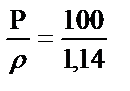 = 87,7 мл. 20,0 % ерітіндінің 100 г не 87,7 мл мөлшерінде 20,0 г H2SO4 бар. Содан кейін бұл ерітіндінің титрін, молярлығын және эквиваленттің молярлы концентрациясын табамыз:
= 87,7 мл. 20,0 % ерітіндінің 100 г не 87,7 мл мөлшерінде 20,0 г H2SO4 бар. Содан кейін бұл ерітіндінің титрін, молярлығын және эквиваленттің молярлы концентрациясын табамыз:
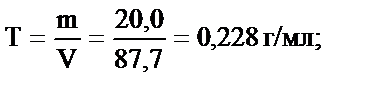
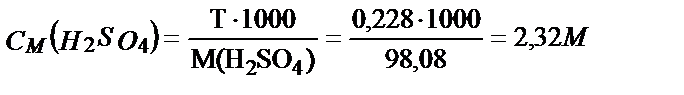
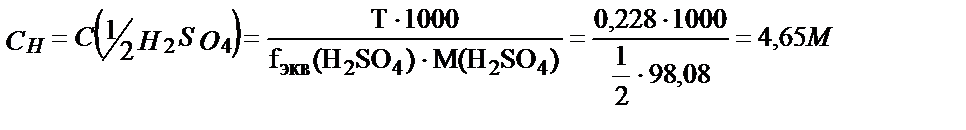 .
.
Жалпы түрде:
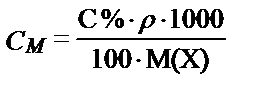 ;
; 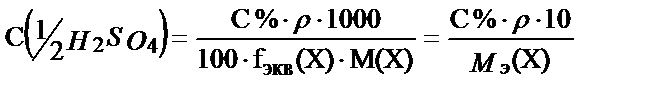
Стандартты (титрленген) ерітінділерді дайындаудың бірнеше жолы бар:
1. Алғашқы стандартты заттың дәл массасын аналитикалық таразыда өлшеп, оны өлшеуіш колбада еріту (стандарттық заттар, не фиксаналдар әдісі). Еріген заттың массасы (m) мен алынған ерітіндінің көлемі белгілі болса (V), бұл ерітіндінің титрін табу қиын емес: T = m/V.
Дәл массасын өлшеуге мынадай шарттарға жауап беретін заттар пайдаланылады:
а) Зат химиялық таза болуы керек, бөгде қоспалардың мөлшері 0,05-0,1 %- тен аспауы керек.
б) Заттың құрамы белгілі химиялық формулаға сәйкес болуы керек.
в) Қатты және ерітінді түріндегі заттың құрамы ауада сақтағанда тұрақты болуы керек.
г) Өлшеу қатесінің мәнін азайту үшін алған заттың молекулалық массасы үлкен болғаны қажет.
Тәжрибеде стандартты ерітінділер дайындауға жиі фиксаналдар пайдаланылады. Фиксанал – дәнекерленген шыны ампулаға салынған, 1 л белгілі концентрациялы (С(f экв,Х)=0,1М ерітінді дайындауға сәйкес, дәл өлшенген зат. Фиксаналды пайдаланып ерітінді дайындау үшін ампуланың ішіндегі затты толығымен 1 л өлшем колбасында ерітеді.
2. Егер зат жоғарыда келтірілген шарттарға жауап бермесе, онда концентрациясы жуық мәнмен белгілі ерітінді дайындалады да, оның дәл концентрациясы басқа стандартты ерітіндіні пайдаланып анықталады.
Ерітіндінің концентрациясын анықтағанда да және анализ жүргізгенде де титрлеудің келесідей екі жолын пайдалануға болады:
1. Алғашқы стандартты не анализдейтін заттың нақты мөлшерін өлшем колбасында ерітеді, белгіге шейін сумен толтырып ерітіндіні дұрыстап араластырады. Ол үшін тығынмен жабылған колбаны бірнеше рет аударады. Осы ерітіндінің пипеткамен аликвотты мөлшерін алып, оны титрлейді.
2. Алғашқы стандартты (не анализдейтін) заттың массасы бір-біріне жуық жеке нақты мөлшерлерін алады, әрқайсысын суда ерітіп, алынған ерітінділерді титрлейді. Бұл әдіс жеке нақты мөлшерлер әдісі деп аталады.
Титриметриялық анализдегі есептеулердің негізі эквиваленттер заңдылығына сүйенген. Реакцияласатын заттардың эквиалентті мөлшерлері бір-біріне тең (nЭ1= nЭ2). Осыдан эквиваленттің молярлы концентрациясына ауыссақ химиялық анализдің негізгі есептеу теңдіктерін аламыз. Эквиваленттің молярлы концентрацияның анықтамасы бойынша ол 1 л ерітіндідегі еріген заттың мольэквивалент (мэкв), не 1 мл ерітіндідегі – миллимольэквивалент (ммэкв) мөлшері. Сондықтан, көлемнің осы концентрацияға көбейтіндісі (С1(f э). V1) осы көлемдегі заттың реакцияға қатысатын ммэкв мөлшерін көрсетеді. Екінші заттың да осындай ммэкв мөлшері реакцияға қатысады (С2(f э). V2), яғни С1(f э).V1 = С2(f э).V2 немесе 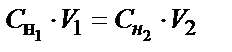
Мысалдар:
1. 25,00 мл тұз қышқылын титрлеуге 32,20 мл 0,0950 М натрий гидроксидінің ерітіндісі жұмсалады. Тұз қышқылы эквивалентінің молярлы концентрациясы неге тең?
СHCl. VHCl = СNaOH. VNaOH

2. 1 л 0,1 М тұз қышқылының ерітіндісін дайындау үшін оның 12,10 М ерітіндісінің қандай көлемін алу керек?
С΄HCl. V΄HCl = С΄΄HCl . V΄΄HCl
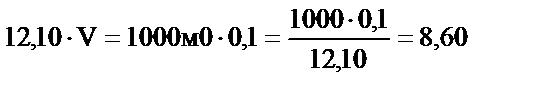 мл
мл
3. 250 мл өлшемдік колбадағы барий гидроксидінің ерітіндісінен титрлеуге оның 20,0 мл алынды, онымен реакцияласуға 22,40 мл 0,09884 М HCl ерітіндісі жұмсалды. Барий гидроксидінің мөлшерін (m) табу керек.
Ba(OH)2 + 2HCl = BaCl2 + 2H2O, fэкв (Ba(OH)2 = 1/2
С(1/2Ba(OH)2).VBa(OH)2= СHCl.VHCl
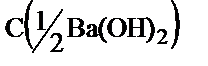 20,00=0,09884.22,40
20,00=0,09884.22,40
 М
М
Осыдан
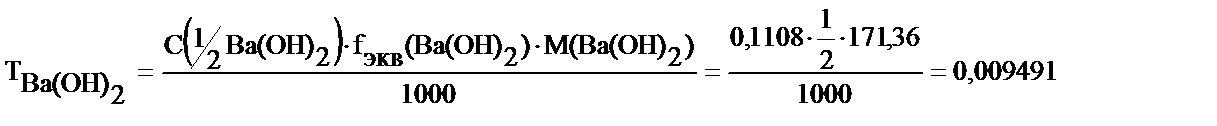
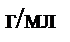
250,0 мл ерітіндіде: m=T. 250,0 = 0,009491 г/мл. 250,0 мл = 2,373 г Ba(OH)2 бар.
Жалпы түрде:

4. 2,606 г техникалық сода 250,0 мл өлшемдік колбада ерітілген. Осы ерітіндінің 25,00 мл көлемімен әрекеттесуге 22,45 мл 0,1095 М тұз қышқылы жұмсалды (индикатор метил-оранж). Na2CO3-тің массалық үлесі неге сәйкес?
Метилоранж индикаторы қатысындағы реакцияның теңдігі:
Na2CO3 + 2HCl = H2O + CO2 + 2NaCl, fэкв.(Na2CO3) = 1/2

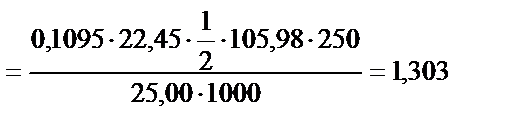 г.
г.
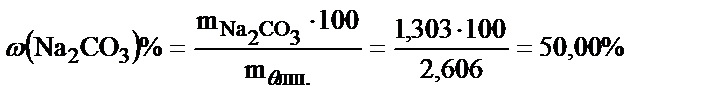
Жеке нақты мөлшерлер әдісі бойынша есептеу.
Мысалдар:
1. 0,1590 г кез келген судың көлемінде еріген қымыздық қышқылын титрлеуге 24,60 мл NaOH ерітіндісі жұмсалған. Осы ерітіндінің эквивалентінің молярлы концентрациясы мен титрі неге сәйкес? (Қымыздық қышқылы – H2C2O4.2H2O).
Бұл есепті шығару үшін екі реакцияға қатысатын заттың мольэквивалент мөлшерлерін табу керек. Реакция мынандай теңдікпен жүргендіктен:
H2C2O4 + 2NaOH = Na2C2O4 + 2H2O, fэкв (H2C2O4) = 1/2
Mr/fэкв(Х)М(Х)г/моль, немесе 
Екінші жағынан NaOH ерітіндісінің бастапқы концентрациясы болса, ол 1 л ерітіндіде С мольэквивалент NaOH, не 1 мл-де С/1000 мольэквивалент NaOH бар екенін көрсетеді. Осыдан реакцияға қатысқан 24,60 мл NaOH ерітіндісіндегі мольэквивалент мөлшері:
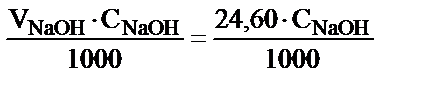
Эквивалент заңдылығынан:
мэкв NaOH = мэкв H2C2O4.2H2O
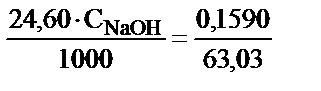 , осыдан
, осыдан

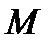
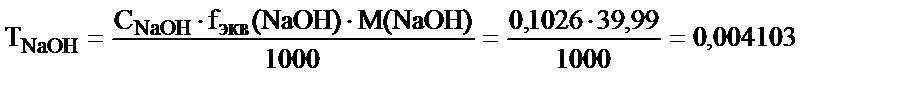
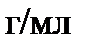
Бұл есепті ерітіндінің анықтайтын зат арқылы титрін пайдаланып та шығаруға болады – TNaOH/H2C2O4.2H2O:
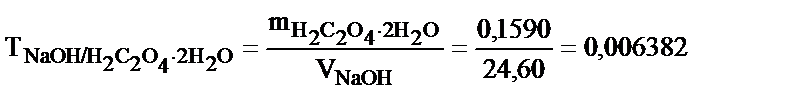
Бұл 1 мл NaOH ерітіндісі 0,006382 г H2C2O4.2H2O -пен әрекеттесетінін көрсетеді. Эквивалентті нүктеде заттардың эквивалентті мөлшерлері әрекеттесетін болғандықтан:
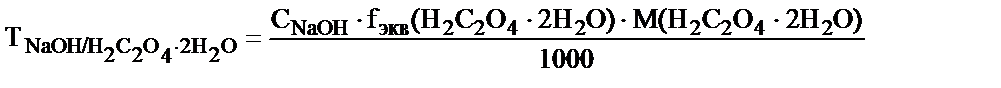
Осыдан
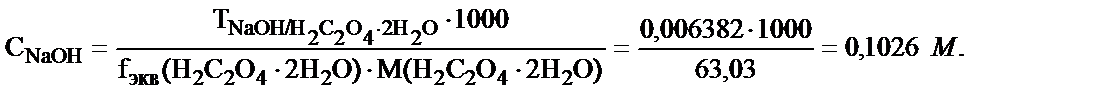
2. Сірке қышқылының ерітіндісін титрлеуге 20,50 мл 0,1145М NaOH ерітіндісі жұмсалды. Есепте неше грамм сірке қышқылы болғаны?
Жоғарыда келтірілгендей NaOH-тың мольэквивалент мөлшері 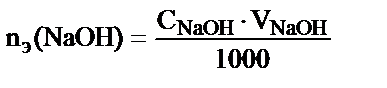 , реакцияға осыншама мольэквивалент (nэ(CH3COOH)) сірке қышқылы қатысады nэ(NaOH) = nэ(CH3COOH).
, реакцияға осыншама мольэквивалент (nэ(CH3COOH)) сірке қышқылы қатысады nэ(NaOH) = nэ(CH3COOH).
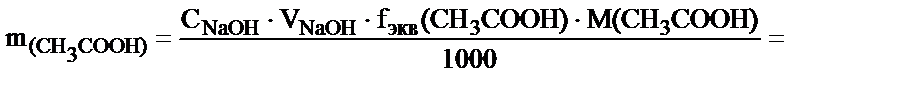
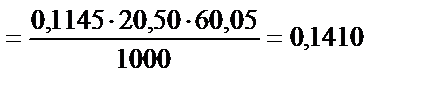 г.
г.
3. Техникалық бураның 0,2298 г мөлшері судың белгісіз көлемінде ерітілді. Осы ерітіндіні титрлеуге 10,60 мл 0,1000 М HCl ерітіндісі жұмсалды. Таза бураның массалық үлесін табу керек.
Na2B4O7+2HCl+5H2O=4H3BO3+2NaCl
fэкв(бура) = 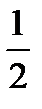 ; nэ(бура) = nэ(HCl)
; nэ(бура) = nэ(HCl)
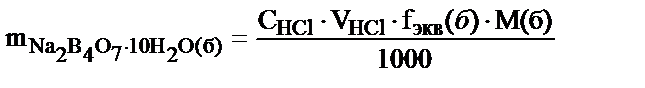 ;
;

Кері титрлеу әдісі бойынша есептеу.
Анализдейтін ерітіндіге (В) стандартты ерітіндінің (А) артық мөлшері қосылады, артық қалған А-ның мөлшерін екінші бір стандартты ерітіндімен (С) титрлейді.
Мысалы, Фольгард әдісімен Cl- ионының концентрациясын анықтау:
NaCl + AgNO3 → AgCl¯ + Na NO3 (артық қалған AgNO3)
артық қалған AgNO3 + NH4SCN → AgSCN¯ +NH4NO3
Егер AgNO3, NH4SCN ерітінділері эквиваленттерінің малярлы концентрациялары және титрлеуге жұмсалған көлемдері белгілі болса, хлор-ионының мөлшерін былай табуға болады:
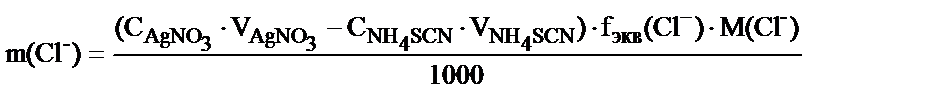
(СAgNO3. VAgNO3 – СNH4SCN. VNH4SCN) – хлор-ионымен реакцияласуға кеткен AgNO3 ерітіндісінің миллимольэквивалент мөлшері.
Егер анализде өлшемдік колба мен пипетка пайдаланылса:
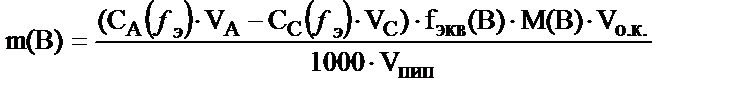
Бақылау сұрақтары мен жаттығулар
1. Титриметриялық анализдің негізі, оның гравиметриялық анализден қандай айырмашылығы бар?
2. Титриметриялық анализде пайдаланылатын реакциялар қандай шарттарға жауап берулері керек?
3. Қандай заттарды “алғашқы”, “стандартты” заттар дейді, оларға қандай шарттар қойылады?
4. Фиксанал деген не?
5. Титрант, стандартты ерітінді, титрлеудің соңғы нүктесі, эквивалентті нүкте деген ұғымдардың қысқаша түсінігін беріңдер.
6. Молярлы ерітінді, эквиваленттің молярлы концентрациясы, мольэквивалент деген ұғымдардың түсінігін беріңдер.
7. Төмендегі реакциялардағы қышқыл, негіз, тұздардың мольэкиваленттері неге тең?
H2SO4 + Ba(OH)2 = BaSO4¯ + 2H2O
H2SO4 + NaOH = NaHSO4 + H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O
K2Cr2O7 + 2BaCl2 + H2O = 2BaCrO4¯ + 2HCl + 2KCl
8. Мына реакциялардағы тотықтырғыштар және тотықсыздандырғыштардың мольэквиваленттері неге тең?
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O + K2SO4
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O
KClO3 + 6HCl + 6FeCl2 = 6FeCl3 + KCl + 3H2O
9. Мына ерітінділердің титрін және эквиваленттің молярлы концентрациясын есептеңдер:
а) HCl 4,0106 г/л
б) H2SO4 2,4029 г / 500 мл
в) BaCl2.2H2O 2,0036 г /250 мл
г) Na2CO3 1,3250 г / 250 мл
10. Мына ерітінділердегі химиялық қосылыстардың массасын (г) табыңдар:
а) 200,0 мл 0,120 М NaOH
б) 50,0 мл 0,200 М H2SO4 С(1/2 H2SO4)
в) 500,0 мл 0,010 М KMnO4 С(1/5 KMnO4)
г) 25,0 мл 0,100 М KSCN
11. 3,0 л 0,100 М HNO3 ерітіндісін дайындау үшін 2,000 М азот қышқылының неше миллилитрін алу керек?
12. Тығыздығы 1,396 г/мл 40,00 % CaCl2 ерітіндісінің эквивалентінің молярлы концентрациясын есептеңдер.
13. Тығыздығы 1,69 г/мл 85,00 % H3PO4 бар ерітіндінің молярлығын есептеңдер.
14. 1,5 л 0,050 М тұз қышқылының ерітіндісін дайындау үшін тығыздығы 1,098 г/мл 20,00 % ерітіндінің қандай көлемін алу керек?
15. Құрамында 0,2586 г Na2B4O7.10H2O бар ерітіндіні титрлеуге 29,75 мл тұз қышқылы жұмсалды. Тұз қышқылы эквивалентінің молярлы концентрациясын және титрін есептеңдер.
16. 0,6000 г H2C2O4.H2O суда ерітілді, осы ерітіндіні титрлеуге 27,09 мл NaOH жұмсалды. Натрий гидроксиді эквивалентінің молярлы концентрациясын және титрін есептеңдер.
17. Таза 1,000 г K2Cr2O7 еріген ерітіндіні титрлеуге 24,00 мл темір (ІІ) ерітіндісі жұмсалды. Осы ерітінді эквивалентінің молярлы концентрациясын және титрін есептеңдер.
18. 1,2568 г H2C2O4.2H2O 100,0 мл өлшем колбасында ерітілді. Алынған ерітіндінің 20,00 мл титрлеуге 18,34 мл NaOH жұмсалды. NaOH эквивалентінің молярлы концентрациясын есептеңдер.
19. Мына өрнектердің THCl/Na2CO3, TAgNO3/Cl, TKMnO4/Fe түсінігін беріңдер. Келтірілген титрлер қандай заттардың грамм мөлшерін көрсетеді?
20. 0,0340 г AgNO3 бар ерітіндіні титрлеуге 20,00 мл HCl жұмсалған. THCl/AgNO3мәнін табыңдар. Бұл ерітінді (HCl) эквивалентінің молярлы концентрациясын неге тең?
21. Мына ерітінділердің титрін табыңдар:
| Берілгені: | Табу керек: |
| а) 0,2500 М HCl | THCl, THCl/CaO |
| б) 0,0500 М (1/6 K2Cr2O7) | TK2Cr2O7, TK2Cr2O7/Fe |
| в) 0,1000 М NaOH | TNaOH, TNaOH/H2C2O4 |
| г) 0,1276 М AgNO3 | TAgNO3, TAgNO3/Cl |
22. 20,00 мл 0,030 М FeSO4 ерітіндісін титрлеуге 0,020 М (1/5 KMnO4) ерітіндісінің неше миллилитрі қажет?
23. 25,50 мл 0,100 М (1/2 H2SO4) ерітіндісімен әрекеттесуге жұмсалатын Na2CO3-тің массасын табыңдар.
24. 15,00 мл KOH ерітіндісін титрлеуге 18,70 мл титрі 0,002864 г/мл –ге тең HCl ерітіндісі жұмсалды. KOH ерітіндісі эквивалентінің молярлы концентрациясын есептеңдер.
25. Құрамында 1,5320 г NaOH бар ерітіндінің 20,00 мл көлемін титрлеуге 14,70 мл HCl (THCl = 0,003800 г/мл) жұмсалды. Алғашқы ерітіндінің көлемін табыңдар.
26. 1,0 л ерітінді дайындауға 5,00 мл тығыздығы 1,470 г/мл 57,36 % күкірт қышқылы жұмсалды. Алынған ерітіндінің титрін және эквивалентінің молярлы концентрациясын есептеңдер.
27. 0,2746 г таза Na2CO3-ті титрлеуге 31,45 мл күкірт қышқылы жұмсалды. Осы қышқылдың эквивалентінің молярлы концентрациясын есептеңдер.
28. 1,0890 г Na2C2O4-ті титрлеуге 25,35 мл калий перманганаты жұмсалды. Калий перманганатының титрін, оның Na2C2O4 арқылы титрін және эквивалентінің молярлы концентрациясын есептеңдер.
29. 6,2270 г бурадан 250,0 мл ерітінді дайындалды. Осы ерітіндінің 25,00 мл титрлеуге 24,17 мл тұз қышқылы жұмсалды. Бура мен тұз қышқылы ерітінділері эквивалентінің молярлы концентрацияларын есептеңдер.
30. Күкірт қышқылды калий иодиді ерітіндісіне 20,00 мл 0,113 М – 0,113 М ( KMnO4)= KMnO4 ерітіндісі қосылды. Бөлініп шыққан иодты титрлеуге 25,91 мл Na2S2O3 жұмсалды. Тиосульфат ерітіндісі эквивалентінің молярлы концентрациясы неге сәйкес?
KMnO4)= KMnO4 ерітіндісі қосылды. Бөлініп шыққан иодты титрлеуге 25,91 мл Na2S2O3 жұмсалды. Тиосульфат ерітіндісі эквивалентінің молярлы концентрациясы неге сәйкес?
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 11163; Нарушение авторских прав?; Мы поможем в написании вашей работы!